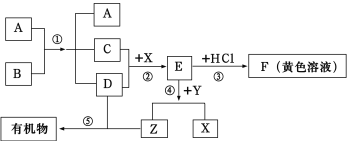
题目内容
【题目】(8分)在化学实验技能考试中,有一题目是鉴别碳酸钠溶液和氢氧化钠溶液,小红等几位同学进行了如下图所示的实验。
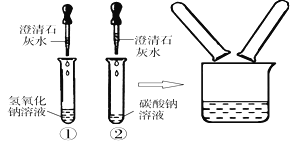
(1)写出试管②中碳酸钠与氢氧化钙反应的化学方程式: 。
(2)实验结束后,小红同学将①、②两支试管中的废液倒入同一个干净的烧杯中,看到废液浑浊,就对废液进行了过滤,小红等几位同学对滤液的成分又进行了探究。
【提出问题】滤液中除水外还含有哪些物质?
【猜想】小红认为:只含氢氧化钠;
小亮认为:可能含有氢氧化钠和碳酸钠;小明认为:可能含有氢氧化钠、碳酸钠和氢氧化钙;
你认为还可能是 (写一种猜想)。
【讨论】你认为小红、小明、小亮三位同学中 的猜想不合理。
【实验设计】设计一个简单的实验证明你的猜想正确。
 【反思拓展】
【反思拓展】
①在分析化学反应后所得物质的成分时,除考虑生成物外还需考虑 。
②通过以上探究,你认为应怎样处理上述实验后的废液才能倒入下水道 。
【答案】(1)Na2CO3+Ca(OH)2==CaCO3+2NaOH
(2)NaOH、Ca(OH)2 小明
加入少量CaCl2溶液 有白色沉淀生成
反应物是否过量
加入适量酸性物质,调节废液pH值等于7后,倒入下水道。
【解析】
试题分析:(1)碳酸钠和氢氧化钙反应生成的是碳酸钙沉淀和氢氧化钠:Ca(OH)2+Na2CO3 = CaCO3↓+2NaOH;
(1)考虑到反应物过量的问题,故可能存在这几种情况:氢氧化钠或氢氧化钠与碳酸钠的混合物或氢氧化钠与氢氧化钙的混合物。由于碳酸钠和氢氧化钙能反应,它们不能共存,故小明猜想不合理;
【实验设计】要证明溶液中含有氢氧化钙,则向溶液中加入碳酸钠即可,若有氢氧化钙那么它们会反应生成碳酸钙沉淀;
【实验分析】由于稀盐酸先与氢氧化钠发生化学反应,故滴入少量的稀盐酸,若存在碳酸钠也不会产生气泡,要用稀盐酸证明碳酸钠的存在,那么要加入足量的稀盐酸;
【反思拓展】在分析化学反应后所得溶液中溶质的成分时,除考虑生成物外还需考虑反应物是否过量。
由于废液的PH大于7,故可加入少量酸性物质使它们发生中和反应后变成中性溶液再排放。

 春雨教育同步作文系列答案
春雨教育同步作文系列答案