题目内容
将质量为92g的铁棒插入一定量的硫酸铜溶液中,过一段时间后取出,洗涤干燥称重质量增加到100g,则所得铁棒中铁的质量分数为( )
|
| A. | 56% | B. | 37.5% | C. | 36% | D. | 55% |
| 根据铁和铜的相对原子质量,计算出置换出的铜的质量,然后利用铁与硫酸铜反应的化学方程式和铜的质量,列出比例式,就可计算出在此过程中参加反应的铁片质量; | |
| 解答: | 解 设在此过程中参加反应的铁片质量为x. Fe+CuSO4=FeSO4+Cu 固体质量变化 56 64 8 x 100g﹣92g=8g
x=56g 故所得的铁棒中铁的质量分数为 故选C |

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
将质量为92g的铁棒插入一定量的硫酸铜溶液中,过一段时间后取出,洗涤干燥称重质量增加到100g,则所得铁棒中铁的质量分数为( )
| A.56% | B.37.5% | C.36% | D.55% |

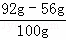 ×100%=36%
×100%=36%