��Ŀ����
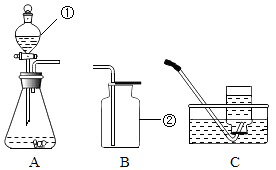
����Ŀ����һ�ձ���ʢ��100gBaCl2��HCl�Ļ����Һ���������μ�������������Ϊ10%��Na2CO3��Һ�������Һ��������������Na2CO3��Һ��������ϵ������ͼ��ʾ�����������ش����⣺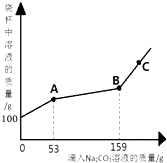
��1��������ʵ������У������Ⱥ���������
��2��������ʵ������У��ų�����������Ϊ g�����ɵij���������Ϊ g��
��3��������Na2CO3��Һ��ͼ��C��ʱ���ձ�����Һ�ﺬ�е������� �� ��д��ѧʽ��
��4��������Na2CO3��Һ��ͼ��B��ʱ��ͨ������������ò�������Һ���������������Ƕ��٣�����������ȷ��0.1%��
���𰸡�
��1���а�ɫ��������
��2��2.2��19.7
��3��Na2CO3��NaCl
��4��
�⣺��ʵ������в����Ȼ�������Ϊy�����������̵ģ���������̼���������ỹ�Ǻ��Ȼ�����Ӧ�����ն�Ӧ���ƶ����Ȼ����У�
Na2CO3 �� | 2NaCl |
106 | 117 |
159g��10% | Y |
![]() =
= ![]()
y=17.55g
����NaCl��Һ����������Ϊ�� ![]() ��100%=7.4%
��100%=7.4%
���������⣺��1��̼���ƺ����ᷴӦ����������̼��������ų������Ȼ�����Ӧ����̼�ᱵ�����а�ɫ������������2����ʵ������зų�������������Ϊx������Na2CO3+2HCl=2NaCl+CO2��+H2O����
Na2CO3 �� | CO2 |
106 | 44 |
53g��10% | X |
53g��10% x![]() =
= ![]()
x=2.2g
��ʵ������в���̼�ᱵ����Ϊz�����ڵ�̼������̼���ת��Ϊ̼�ᱵ���������Զ�Ӧ��̼������53g��Һ֮��IJ���Ϊ159g��53g=106g��
Na2CO3 ��B | BaCO3 |
106 | 197 |
106g��10% | Z |
![]() =
= ![]()
z=19.7g��3��̼���ƺ��Ȼ�������̼�ᱵ�������Ȼ��ƣ�̼���ƺ����ᷴӦ�����Ȼ��ơ�ˮ�Ͷ�����̼��������Na2CO3��Һ��ͼ��C��ʱ��̼�����ǹ����ģ������ձ�����Һ�ﺬ�е������ǣ�Na2CO3��NaCl��
���Դ��ǣ���1��������ɫ������2��2.2�ˣ�19.7�ˣ���3��Na2CO3��NaCl����4��7.4%��
�����㾫����������Ĺؼ�����������ݻ�ѧ��Ӧ����ʽ�ļ�������֪ʶ�����ո����ʼ�������=ϵ������Է�������֮�ȣ�

 ��ʦָ����ĩ��̾�ϵ�д�
��ʦָ����ĩ��̾�ϵ�д� �����ܿ����ϵ�д�
�����ܿ����ϵ�д�