题目内容
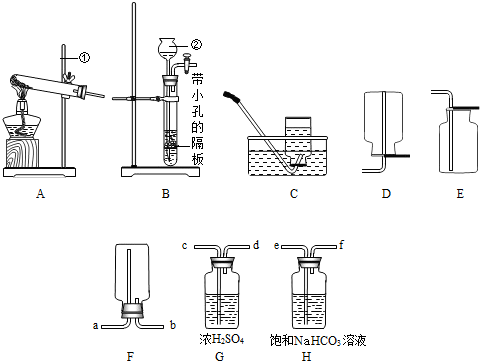
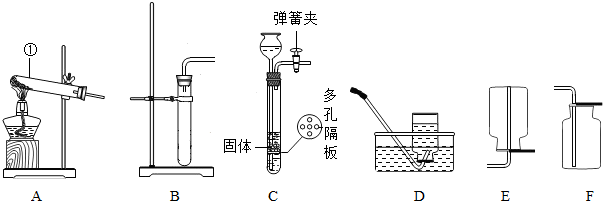
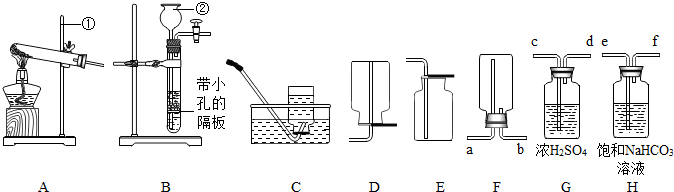
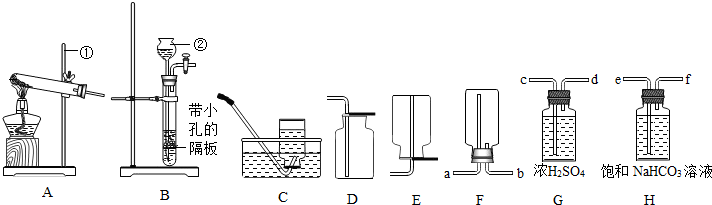
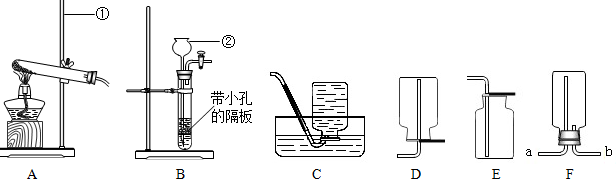
(16分)下列装置常用于实验室制取气体。根据给出的装置回答下列问题:
A B C D E F G H
(1)指出编号仪器名称:① ;② 。
(2)实验室利用A装置制取氧气,反应原理用化学方程式表示为 。利用C装置收集氧气的最佳时刻是 。用收集到的氧气完成硫粉燃烧实验后,还需向集气瓶内加入适量氢氧化钠溶液,目的是 (用化学方程式表示)。
(3)制取并收集二氧化碳应选择的装置是 (从A——E中选择),使用该套装置制取气体的突出优点是 ,该反应原理用化学方程式表示为 。若改用F装置收集二氧化碳,则气体应从 端进入。制得的二氧化碳中常含有少量的氯化氢气体与水蒸气,欲使个G、H装置将以上杂质气体除去,则装置正确的连接顺序是:混合气体→ (用端口字母表示)。
(4)将纯净的二氧化碳气体通入盛有蒸馏水的洗气瓶一段时间后,测得该装置中溶液的pH、
(填“>”、“<”或“=”)7,对该现象的合理解释为 (用化学方程式表示)。
⑴① 铁架台 ② 长颈漏斗
⑵2KClO3 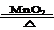 2KCl+ 3O2↑ 导管口有气泡连续均匀冒出时
2KCl+ 3O2↑ 导管口有气泡连续均匀冒出时
2NaOH + SO2 = Na2SO3 + H2O
⑶ BE (1分) 可以随时控制反应发生或停止(1分)
CaCO3+2HCl=CaCl2 + H2O +CO2↑(2分) b efcd (或efc)
⑷ < H2O +CO2 = H2CO3
解析试题分析:(1)根据实验室常用仪器回答,图中仪器①是铁架台,②是长颈漏斗;
(2)由A装置可知,此装置是加热固体制取气体的装置,如制取氧气,可用加热氯酸钾和二氧化锰混合物的方法,故反应的化学方程式是2KClO3 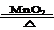 2KCl+ 3O2↑;由于试管中本身存在一定量的空气,要获取纯净的氧气,需要排尽试管中的空气后再收集,如用排水法收集氧气,则其最佳时刻是导管口有气泡连续均匀冒出时,再开始收集;由于二氧化硫是一种有害的气体,排放到空气中会造成空气污染,故可利用其能与氢氧化钠反应的性质将其吸收掉,则反应的化学方程式是2NaOH+SO2=Na2SO3+H2O;
2KCl+ 3O2↑;由于试管中本身存在一定量的空气,要获取纯净的氧气,需要排尽试管中的空气后再收集,如用排水法收集氧气,则其最佳时刻是导管口有气泡连续均匀冒出时,再开始收集;由于二氧化硫是一种有害的气体,排放到空气中会造成空气污染,故可利用其能与氢氧化钠反应的性质将其吸收掉,则反应的化学方程式是2NaOH+SO2=Na2SO3+H2O;
(3)实验室常用大理石和稀盐酸反应制取二氧化碳,反应物的状态是固体和液体,反应条件是常温,故属于“固液不加热型”,应选用发生装置B;由于二氧化碳的密度大于空气的密度,且能溶于水,故只能用向上排空气法收集,应选用收集装置E;由于B装置中有个带孔的隔板,能起到隔绝固液体的作用,故使用该套装置制取气体的突出优点是:可以随时控制反应发生或停止;大理石和稀盐酸反应,生成氯化钙、水和二氧化碳,故该反应的化学方程式为:CaCO3+2HCl=CaCl2+ H2O +CO2↑;若改用F装置收集二氧化碳,由于二氧化碳的密度大于空气的密度,要用向上排空气法收集,则二氧化碳气体应从b 端进入(从下面往上排空气);要除去二氧化碳中含有的少量的氯化氢气体与水蒸气,应先将氯化氢气体除去(用饱和碳酸氢钠),再除去水蒸气(用浓硫酸),则装置正确的连接顺序是:混合气体→efcd;
(4)由于二氧化碳能与水反应生成了碳酸,所以溶液的pH小于7,其反应的化学方程式是H2O+CO2=H2CO3。
考点:常用气体的发生装置和收集装置与选取方法,气体的净化(除杂),实验室制取氧气的反应原理,二氧化碳的实验室制法,二氧化碳的化学性质,碱的化学性质,溶液的酸碱性与pH值的关系,书写化学方程式
点评:熟记氧气和二氧化碳的实验室制法、原理和操作注意事项,是解题的关键;此外,本题的重点是常用气体的发生装置和收集装置的选取方法,要学会根据反应物的状态和反应的条件选择发生装置,根据制取气体的溶解性和密度的大小选择收集气体的方法。

 阅读快车系列答案
阅读快车系列答案