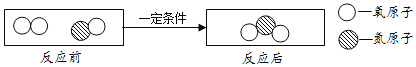
题目内容
【题目】硝酸铵NH4NO3和尿素CO(NH2)2农业上常用的氮肥,请根据化学式计算:
(1)硝酸铵的相对分子质量_________
(2)硝酸铵中各元素的质量比,N:H:O=_________
(3)尿素中各元素的原子个数比为,C:O:N:H=_________
(4)作为氮肥,硝酸铵和尿素含氮量更高的是_________
(5)8t硝酸铵中含氮元素的质量是___________;_____________t尿素与之含有相等质量的氮元素。
【答案】80 7:1:12 1:1:2:4 尿素 2.8t 6
【解析】
(1)硝酸铵的相对分子质量为14×2+1×4+16×3=80;
(2)硝酸铵中氮、氢、氧元素的质量比为(14×2):(1×4):(16×3)=7:1:12;
(3)根据尿素的化学式可知,尿素中各元素的原子个数比为,C:O:N:H=1:1:2:4;
(4)硝酸铵中氮元素的质量分数为![]() ,尿素中氮元素的质量分数为
,尿素中氮元素的质量分数为![]() ,作为氮肥,硝酸铵和尿素含氮量更高的是尿素;
,作为氮肥,硝酸铵和尿素含氮量更高的是尿素;
(5)8t硝酸铵中含氮元素的质量=8t×35%=2.8t;
设尿素的质量为x,则有:2.8t=x×![]() x=6t。6t尿素与之含有相等质量的氮元素。
x=6t。6t尿素与之含有相等质量的氮元素。

【题目】水和溶液与生产生活息息相关。请完成下面小题。
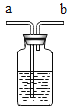
【1】电解水实验能够证明水的组成,其实验装置如图所示。
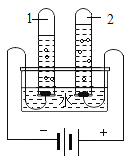
(1)试管1中生成的气体为__________。
(2)该反应的化学方程式为__________。
【2】请从A或B两题中任选一个作答,若两题均作答, A计分。
A | B |
太阳能吸附式制冷结露法空气取水器可在野外获取淡水,吸附剂中主要物质为SiO2和CaCl2。 (1)SiO2属于________(填字母序号)。 A 氧化物 B 化合物 C 混合物 (2)CaCl2中钙元素的质量分数为________(写出计算式即可)。 | 水净化过程中常用的消毒剂有: O3、Cl2、Ca(ClO)2、ClO2。 (1)上述物质中,属于氧化物的是_______。 (2)Ca(ClO)2中钙元素与氧元素的质量比为_______。 |
【3】水常用来配制各种溶液。
(1)硝酸钾溶液是常用的一种无土栽培的营养液。硝酸钾溶液中的溶质是_______。
(2)10%的CaCl2溶液可作路面保湿剂。欲配制100 kg该路面保湿剂,需要水的质量是_____ kg。