题目内容
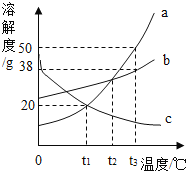
【题目】现有Fe2(SO4)3和CuSO4的混合溶液400.0g,向其中加入铁粉,搅拌使之充分反应,已知铁粉先与Fe2(SO4)3溶液发生反应,反应为:Fe2(SO4)3+Fe=3FeSO4,如图为加入铁粉的质量与烧杯中剩余固体质量关系.下列说法不正确的是( )

A. a~b段溶液中有2种溶质
B. m=6.4
C. 取c点固体加入足量稀盐酸,固体全部溶解
D. 原溶液中的Fe2(SO4)3质量分数为10.0%
【答案】C
【解析】通过分析图象可知,0~a是铁与硫酸铁反应,参加反应的铁的质量为5.6g,a~b是铁和硫酸铜反应,参加反应的铁的质量5.6g,所以
Fe2(SO4)3+Fe=3FeSO4
400 56 456
40g 5.6g 45.6g
CuSO4+Fe=FeSO4+Cu
16056 152 64
16g 5.6g 15.2g 6.4g
A、a~b段溶液中有硫酸铜、硫酸亚铁2种溶质,正确; B、0~a段铁也硫酸铁反应,a~b段铁与硫酸铜反应,所以并非解析中所说a~b溶质为硫酸铁(已完全反应)和硫酸亚铁,应为硫酸亚铁和硫酸铜;b点硫酸铜完全反应,剩余固体只有铜,所以m=6.4g,正确;C、取c点固体加入足量稀盐酸,固体中还有不能溶解的铜,错误;D、原溶液中的Fe2(SO4)3质量分数为![]() ×100%=10.0%,正确。故选C。
×100%=10.0%,正确。故选C。

练习册系列答案
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案
相关题目