题目内容
【题目】为了测定生铁中铁的质量分数,某校化学兴趣小组进行了实验研究,取6g生铁与溶质的质量分数为14.6%的盐酸反应(生铁中杂质不溶于水,也不与盐酸反应,并绘制了加入盐酸质量与放出气体质量的关系图. 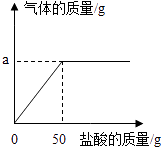
(1)求a的值.
(2)6g生铁与溶质的质量分数为14.6%的盐酸恰好完全反应时所得不饱和溶液中溶质的质量分数为多少?(保留一位小数)
【答案】
(1)解:参加反应的HCl的质量为50g×14.6%=7.3g,
设生成的氢气的质量为x,生成的氯化亚铁的质量为y,参加反应的铁的质量为z
Fe+ | 2HCl= | FeCl2+ | H2↑ |
56 | 73 | 127 | 2 |
z | 7.3g | y | x |
![]() =
= ![]() =
= ![]() =
= ![]()
x=0.2g
y=12.7g
z=5.6g
答:a的值为0.2g
(2)解:所以反应后所得溶液的溶质质量分数为: ![]() ×100%=22.9%
×100%=22.9%
【解析】解(1)参加反应的HCl的质量为50g×14.6%=7.3g, 设生成的氢气的质量为x,生成的氯化亚铁的质量为y,参加反应的铁的质量为z
Fe+ | 2HCl= | FeCl2+ | H2↑ |
56 | 73 | 127 | 2 |
z | 7.3g | y | x |
![]() =
= ![]() =
= ![]() =
= ![]()
x=0.2g
y=12.7g
z=5.6g
【考点精析】通过灵活运用根据化学反应方程式的计算,掌握各物质间质量比=系数×相对分子质量之比即可以解答此题.

练习册系列答案
 智慧小复习系列答案
智慧小复习系列答案
相关题目