题目内容
【题目】还原性铁粉在潮湿的空气中容易生锈.现有m1 g生锈的铁粉样品,某兴趣小组同学按溶液图所示装置进行实验,测定该样品中氧化铁的质量分数(铁锈按氧化铁处理).
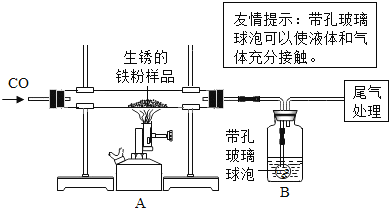
(1)装置A中反应的化学方程式是_____.
(2)某同学欲通过B装置反应前后的质量变化,测定该样品中氧化铁的质量分数.B中的最佳试剂是_____(填序号),实验时B中反应的化学方程式是_____.
①澄清石灰水 ②氢氧化钠浓溶液 ③稀盐酸 ④水
(3)上述实验过程中,CO气体除作为反应物外,还能起到的作用是:①实验开始时,排尽装置中的空气,防止加热时发生爆炸;②停止加热后,防止A中生成物被氧化,B中的溶液倒吸入A中;③_____.
(4)完全反应后,甲同学称得铁粉的质量为m2 g,同时测得装置B增重m3 g,则铁粉样品中氧化铁的质量分数为_____.
(5)请你说说尾气的处理方法_____.
【答案】3CO+Fe2O3![]() 2Fe+3CO2 ② CO2+2NaOH=Na2CO3+H2O 将装置中的CO2送入NaOH溶液中
2Fe+3CO2 ② CO2+2NaOH=Na2CO3+H2O 将装置中的CO2送入NaOH溶液中 ![]()
![]() 100%或
100%或![]() ×100% 用气球收集
×100% 用气球收集
【解析】
(1)一氧化碳还原氧化铁的化学反应式是:3CO+Fe2O3![]() 2Fe+3CO2;
2Fe+3CO2;
(2)能很好的吸收二氧化碳的物质是氢氧化钠浓溶液,所以欲通过B装置反应前后的质量变化,测定该样品中氧化铁的质量分数.应选用的最佳试剂是②氢氧化钠浓溶液;它与二氧化碳的化学反应式是:CO2+2NaOH=Na2CO3+H2O;
(3)CO除上述两作用外,作还原剂还原氧化铁;
(4)思路1:装置B增重m3g,说明有m3g二氧化碳生成,设生成m3g二氧化碳需要氧化铁x,
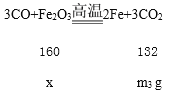
![]()
x=![]() ,
,
所以样品中含氧化铁的质量分数是:![]()
![]() 100%=
100%=![]()
![]() 100%;
100%;
思路2:由于固体是质量减少的,所以也可以借助m1﹣m2质量差值来求算氧化铁的质量,所以设氧化铁的质量为y,

![]()
y=![]() (m1﹣m2)g,
(m1﹣m2)g,
所以样品中含氧化铁的质量分数为![]() ×100%=
×100%=![]() ×100%;
×100%;
(5)用气球收集或用酒精灯点燃该气体。

 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案