题目内容
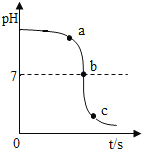
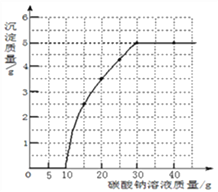
【题目】实验室用过量的稀盐酸和大理石制取CO2,取50g反应后的滤液,逐滴滴入碳酸钠溶液,测得滴入碳酸钠溶液的质量与产生沉淀质量的关系曲线如图所示。认真读图并仔细分析,抽取其中有用的信息,完成下列计算:
(1) 原滤液中氯化钙的质量分数为______________。
(2) 所用碳酸钠溶液的溶质质量分数为______________。
【答案】 11.1% 26.5%
【解析】本题考查了根据化学反应方程式的计算。结合反应过程对图像的数据正确处理是解题的关键。
(1)由图可以看出,生成沉淀的最大质量是5g;
设:原滤液中CaCl2的质量为x,与CaCl2反应的碳酸钠质量为y。
Na2CO3+CaCl2=CaCO3↓+2NaCl
106 111 100
Y x 5g
![]() x=5.55g
x=5.55g
原滤液中氯化钙的质量分数为=![]() ×100%=11.1%;
×100%=11.1%;
(2)![]() y=5.3g;
y=5.3g;
根据图像可知与CaCl2反应的碳酸钠溶液质量=30g-10g=20g;
所用碳酸钠溶液的溶质质量分数=![]() ×100%=26.5%。
×100%=26.5%。
答:(1) 原滤液中氯化钙的质量分数为11.1%。
(2) 所用碳酸钠溶液的溶质质量分数为26.5%。

练习册系列答案
相关题目