题目内容
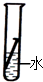
有等质量的A、B两金属,相对原子质量Ar(A) <Ar(B),将A放入质量分数为15%的稀硫酸中,B放入质量分数为15%的稀盐酸中,在反应中A、B均为正二价,产生氢气的质量随反应时间变化曲线如右图。下列说法正确的是
A.产生氢气的速率A<B
B.反应后A、B一定都有剩余
C.消耗的稀硫酸和稀盐酸质量一定不相等
D.消耗B的质量一定小于A的质量
C
解析:略

练习册系列答案
相关题目
人类的生产、生活离不开金属。
(1)用铜制电线主要是利用铜具有良好的 性。
(2)人们常用“铜墙铁壁”来形容物体的坚固。但铁在 一定条件下也能发生各种反应,
一定条件下也能发生各种反应,
如铁丝在氧气中燃烧,反应的化学方程式是________________________________。
(3)铁制品锈蚀,实际上是铁跟空气中的 发生了化学反应。防止铁制栏杆锈
蚀的一种方法是 ________________________ 。
(4)根据下 图所示回答:滤渣中一定有的金属是 ____ ,滤渣与稀硫酸反应的化学方
图所示回答:滤渣中一定有的金属是 ____ ,滤渣与稀硫酸反应的化学方
程式为_______________________________________。
 |
(5)把某稀硫酸分为等体积的两份,放入两个烧杯中,分别加入等质量的锌、铁两种金
属,反应后金属都没有剩余,产生氢气的质量随反应时间变化曲线如图。下列说法
正确的是___________。(填字母序号)
A.甲是铁,乙是锌
B.铁消耗硫酸的质量比锌大
C.参加反应的锌的质量小于铁的质量
D.充分反应后,稀硫酸一定都有剩余

 (2012?金牛区一模)如图是甲乙两种固体物质的溶解度曲线.据图回答:
(2012?金牛区一模)如图是甲乙两种固体物质的溶解度曲线.据图回答: (2013?呼和浩特)金属与我们的生活息息相关,在各个领域中用途广泛.
(2013?呼和浩特)金属与我们的生活息息相关,在各个领域中用途广泛. B、
B、 C、
C、 D、
D、