题目内容
【题目】小明同学在理化实验考查中抽到的考题是“探究某种盐的性质”,他按照实验流程将一定质量该白色固体溶于水配成溶液,再用贴有标号的3支试管分别取适量上述溶液,按照如图1所示的方法进行实验。
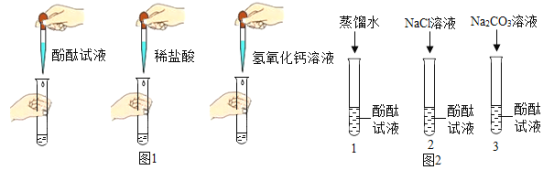
[查阅资料]氯化钙溶液呈中性。
Ⅰ. [实验现象]A.溶液变红;B.__________________;C.产生白色沉淀。根据以上现象,小明得出结论:白色固体为碳酸钠。根据该结论写出试管C中发生的化学反应方程式_________________。
Ⅱ.考试结束后,小明和小伙伴们讨论结果,提出问题,并在老师的指导下继续进行探究实验。
[提出问题)酚酞试液变红究竟与溶液中哪种微粒有关呢?
[进行实验]同学们取了三份酚酞试液进行如图2实验:
(1)实验1的目的是为了说明水分子不能使酚酞变红。小明认为实验1没必要做,你认为小明的理由是_________________。
(2)实验2中酚酞试液未变红。
(3)实验3滴入碳酸钠溶液,振荡,酚酞试液变红,向变红后的溶液中再滴加过量的氯化钙溶液,振荡,观察到的现象是_________________。
[得出结论]酚酞试液变红与溶液中的_______________ (填离子符号)有关。
[实验反思]若将[进行实验](3)中的氯化钙溶液换成石灰水,能否得出同样的结论?原因是_________________。
【答案】产生气泡 ![]() 酚酞试液中含有水 产生白色沉淀,溶液由红色变成无色 CO32- 不能,Ca( OH)2与Na2CO3反应能生成NaOH,溶液仍为红色,干扰实验结果
酚酞试液中含有水 产生白色沉淀,溶液由红色变成无色 CO32- 不能,Ca( OH)2与Na2CO3反应能生成NaOH,溶液仍为红色,干扰实验结果
【解析】
[实验现象]滴加酚酞试液时溶液变红色,说明溶液显碱性,加入氢氧化钙溶液时产生白色沉淀,说明溶液中含有碳酸根离子,加入稀盐酸时反应生成二氧化碳,因此实验现象为:①溶液变红;②产生气泡;③产生白色沉淀。故填:产生气泡;
碳酸钠与氢氧化钙反应生成碳酸钙白色沉淀和氢氧化钠;故填:Na2CO3+Ca(OH)2=CaCO3↓+2NaOH;
[进行实验](1)因为酚酞试液中含有水,且溶液没有变色,所以实验1没必要做;故填:酚酞试液中含有水;
(3)实验3滴入碳酸钠溶液,振荡,酚酞试液变红,向变红后的溶液中再滴加过量的氯化钙溶液,振荡,碳酸钠和氯化钙反应生成碳酸钙沉淀和氯化钠,溶液变成中性,由红色变成无色,观察到产生白色沉淀,溶液由红色变成无色。故填:产生白色沉淀,溶液由红色变成无色;
[得出结论]溶液中的水分子、钠离子都不能使酚酞试液变红色,因此酚酞试液变红与溶液中的CO32-有关。故填:CO32-;
[实验反思]若将步骤(4)中的氯化钙溶液换成石灰水,不能得出同样的结论,原因是Ca(OH)2与Na2CO3反应能生成NaOH,溶液仍为红色。
故填:不能,Ca(OH)2与Na2CO3反应能生成NaOH,溶液仍为红色,干扰实验结果。