��Ŀ����
����Ŀ��ͬѧ�Ƕ�֪��CuSO4��Һ����ɫ����ô������֪������Һ��ʲô��ʹCuSO4��Һ����ɫ�𣿻��ڳ�����ѧ֪ʶ��������Ҫ���ò�ͬ��˼ά��ʽ�Ը��������̽�֣�
��˵����������Һ��Ϊϡ��Һ����ϡ��Һ��SO42����Cl������ɫ����
��1��˼·һ�����ù��ɷ����ɾ�����ʵ����������һ��ԭ������ۣ�
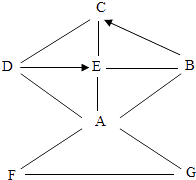
ͼһ ��Ƚ�A��B��C��D��E��֧�Թ�����ʢ�Լ�����ɫ�������������з�����
�ٶ� A��B��C�ķ����ǣ�A��B����Һ�о���Cu2+ �� ������ɫ��˵���Ĵ���ʹCuSO4��CuCl2��Һ����ɫ��
�ڶ�D��E����������˵������ˮ��Һ�У�Na+����ɫ�ģ�
��A��D�ķ����ǣ�A��D����Һ�о���ˮ���ӡ���������ӣ�ˮ���Ӳ���ʹ��Һ����ɫ����ϡ��Һ��SO42������ɫ��A��D����Һ�о���ˮ���ӡ���������ӣ�ˮ���Ӳ���ʹ��Һ����ɫ����ϡ��Һ��SO42����˵��A����Cu2+ʹCuSO4��Һ����ɫ����B��E����ͬ����
��A��B��C��D��E ����������ˮ����ɫҺ�壬��Ϊ�ܼ����ܽ�CuSO4��CuCl2������ʱ����Һ����ɫ��Ҫ�����ʵ�Ӱ�죮
��2��˼·�������ü����Լ�������ѧ��Ӧ�ķ�������Һ�е�Cu2+��ȥ����Һ��Cu2+�Ĵ��ڣ��۲���Һ��ɫ�Ƿ�仯�ķ�����
��ͼ����ʾ�ķ����DZ�����Һ�е�Cu2+ �� �÷�Ӧ�Ļ�ѧ����ʽΪ��
��ѡ��һ���Լ���CuSO4��Һ��Ӧ����ȥ��Һ��Cu2+ �Ĵ��ڣ��仯ѧ����ʽ�ǣ�
�����о��������ò�ͬ��˼ά��ʽ���Ӳ�ͬ��������о�ͬһ�����⣬������˼·��Ȼ�ǶԱ�ʵ����Ƶ�һ��˼·��
���𰸡�
��1��Cu2+��D��E
��2��CuSO4+BaCl2=BaSO4��+CuCl2��2NaOH+CuSO4=Cu��OH��2��+Na2SO4
���������⣺����A��B��C��֧�Թ�����ʢ�Լ�����ɫ����������ˮ����ɫ�ģ�A��B����Һ�о���Cu2+ �� ������ɫ��˵��Cu2+�Ĵ���ʹCuSO4��CuCl2��Һ����ɫ��
D��E��֧�Թ��о��������ӣ��������⣬��ϡ��Һ��SO42����Cl������ɫ��˵����ˮ��Һ�У�Na+����ɫ�ģ�
���ݶ�A��D�ķ�����A��D����Һ�о���ˮ���ӡ���������ӣ�ˮ���Ӳ���ʹ��Һ����ɫ����ϡ��Һ��SO42������ɫ��˵��A����Cu2+ʹCuSO4��Һ����ɫ��
ѡ��һ���Լ���CuSO4��Һ��Ӧ��������Һ��Cu2+ �Ĵ��ڣ���ѡ���Ȼ���������ͭ��Ӧ����Ӧ�Ļ�ѧ����ʽΪ��CuSO4+BaCl2=BaSO4��+CuCl2 ��
��ͼ����ʾ�ķ����dz�ȥ��Һ�е�Cu2+ �� ����������������ͭ��Ӧ����������ͭ�����������ƣ���Ӧ�Ļ�ѧ����ʽΪ��2NaOH+CuSO4=Cu��OH��2��+Na2SO4��
���Դ��ǣ���1����Cu2+����D��E����2��CuSO4+BaCl2=BaSO4��+CuCl2��2NaOH+CuSO4=Cu��OH��2��+Na2SO4��
�����㾫����������Ĺؼ�����������д��ѧ����ʽ�����ֱ���ʽ�����뷽��ʽ�����֪ʶ������ע�⣺a����ƽ b������ c�����ţ�