题目内容
实验室用过氧化钠(Na2O2)和水反应制取氧气,反应的化学方程式为:2Na2O2+2H2O=4NaOH+O2↑如果用31.2g Na2O2来制取氧气,试计算:(1)需要水的质量;______
(2)生成氧气的质量;______
(3)生成的氧气在标准状况下的体积(已知在标准状况下每32g氧气的体积约是22.4L).______
(计算结果准确至0.01L)
【答案】分析:根据反应化学方程式,根据已知量(过氧化钠质量)计算需要水的质量、生成氧气的质量;
根据“已知在标准状况下每32g氧气的体积约是22.4L”可换算出生成的氧气在标准状况下的体积;
解答:解:设需要水的质量为x、生成O2的质量为y
2Na2O2+2H2O=4NaOH+O2↑
156 36 32
78g x y
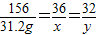
解之得x=7.2g,y=6.4g
O2在标准状况下的体积为:6.4g÷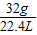 ═4.48L
═4.48L
答:(1)需要水的质量为7.2g
(2)生成氧气的质量为6.4g
(3)生成的氧气在标准状况的体积是4.48L
故答案为:(1)7.2g、(2)6.4g、(3)4.48L
点评:根据反应的化学方程式进行计算时,所使用的物质的质量必须为完全反应的物质的质量,未参加反应的物质质量不能代入化学方程式进行计算.
根据“已知在标准状况下每32g氧气的体积约是22.4L”可换算出生成的氧气在标准状况下的体积;
解答:解:设需要水的质量为x、生成O2的质量为y
2Na2O2+2H2O=4NaOH+O2↑
156 36 32
78g x y
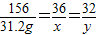
解之得x=7.2g,y=6.4g
O2在标准状况下的体积为:6.4g÷
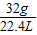 ═4.48L
═4.48L答:(1)需要水的质量为7.2g
(2)生成氧气的质量为6.4g
(3)生成的氧气在标准状况的体积是4.48L
故答案为:(1)7.2g、(2)6.4g、(3)4.48L
点评:根据反应的化学方程式进行计算时,所使用的物质的质量必须为完全反应的物质的质量,未参加反应的物质质量不能代入化学方程式进行计算.

练习册系列答案
相关题目