题目内容
【题目】铜锌合金又叫黄铜,外观酷似黄金,极易以假乱真。某化学兴趣小组的同学对某黄铜样品进行如下实验检测,请计算:
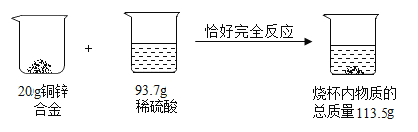
(1)实验中产生氢气的质量为_____g。
(2)20g黄铜样品中铜的质量_____。
(3)计算所得溶液中溶质的质量分数_____。(结果精确到0.1%)
【答案】0.2 13.5g 16.1%
【解析】
依据图示的信息,利用质量守恒定律可以求出生成氢气的质量,利用氢气的质量结合化学方程式可以求出锌的质量和所得溶液中溶质质量进而即可解答。
解:(1)由质量守恒定律可得生成氢气的质量为20.0g+93.7g﹣113.5g=0.2g;
(2)设20g黄铜中锌的质量是x,生成硫酸锌的质量为y。

![]()
![]() ,x=6.5g
,x=6.5g
![]() ,y=16.1g
,y=16.1g
则样品中铜的质量为20g﹣6.5g=13.5g
答:20g黄铜样品中铜的质量是13.5g。
(3)所得溶液中溶质的质量分数为![]()
答:所得溶液中溶质的质量分数为16.1%。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目