题目内容
 取10%的氯化钠溶液117g 进行电解,反应的化学方程式为:2NaCl+2H2O═Cl2↑+H2↑+2NaOH 生成氯气的质量与时间的关系如右图所示.请计算:
取10%的氯化钠溶液117g 进行电解,反应的化学方程式为:2NaCl+2H2O═Cl2↑+H2↑+2NaOH 生成氯气的质量与时间的关系如右图所示.请计算:
(1)配制10%的氯化钠溶液117g需氯化钠多少克?水多少毫升?(水的密度为1.0g?cm-3)
(2)当氯化钠完全反应时,生成氢气多少克?
解:由于根据题意可以得出氯化钠的质量,因此可以根据这个已知量展开计算.故答案为:
(1)需氯化钠质量=117g×10%=11.7g
水的体积=(117-11.7)g÷1.0g?cm-3=105.3cm3=105.3mL
(2)设生成氢气的质量为x.
2NaCl+2H2O═Cl2↑+H2↑+2NaOH
117 2
11.7g x
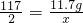
x=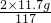 =0.2g
=0.2g
答:(1)需氯化钠11.7g,水105.3mL;(2)生成氢气0.2g.
分析:根据化学方程式进行计算,首先找出已知量和未知量,再就是注意溶液中溶质的质量分数=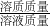 ×100%这个式子中涉及的量的灵活换算.
×100%这个式子中涉及的量的灵活换算.
点评:本题难度不大,主要考查了溶液中溶质质量分数的有关简单计算及根据化学方程式的有关计算,从而培养学生的计算能力.
(1)需氯化钠质量=117g×10%=11.7g
水的体积=(117-11.7)g÷1.0g?cm-3=105.3cm3=105.3mL
(2)设生成氢气的质量为x.
2NaCl+2H2O═Cl2↑+H2↑+2NaOH
117 2
11.7g x
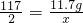
x=
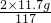 =0.2g
=0.2g答:(1)需氯化钠11.7g,水105.3mL;(2)生成氢气0.2g.
分析:根据化学方程式进行计算,首先找出已知量和未知量,再就是注意溶液中溶质的质量分数=
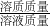 ×100%这个式子中涉及的量的灵活换算.
×100%这个式子中涉及的量的灵活换算.点评:本题难度不大,主要考查了溶液中溶质质量分数的有关简单计算及根据化学方程式的有关计算,从而培养学生的计算能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 取10%的氯化钠溶液117g 进行电解,反应的化学方程式为:2NaCl+2H2O═Cl2↑+H2↑+2NaOH 生成氯气的质量与时间的关系如右图所示.请计算:
取10%的氯化钠溶液117g 进行电解,反应的化学方程式为:2NaCl+2H2O═Cl2↑+H2↑+2NaOH 生成氯气的质量与时间的关系如右图所示.请计算: 取10%的氯化钠溶液117g进行电解,反应的化学方程式为:2NaCl+2H2O═Cl2↑+H2↑+2NaOH生成氯气的质量与时间的关系如图所示.请计算:
取10%的氯化钠溶液117g进行电解,反应的化学方程式为:2NaCl+2H2O═Cl2↑+H2↑+2NaOH生成氯气的质量与时间的关系如图所示.请计算:
