题目内容
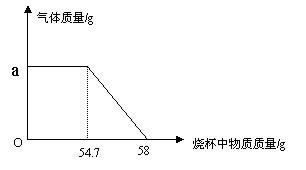 现有一种碳酸钙样品。为测定样品中碳酸钙的质量分数,实验小组进行了如下实验:
现有一种碳酸钙样品。为测定样品中碳酸钙的质量分数,实验小组进行了如下实验:
①称取一定量样品放入一烧杯中;
②再往上述烧杯中加入50g足量的盐酸充分反应;
③绘制放出气体与烧杯中物质质量的关系图(见下图)。
(温馨提示:图中58g为反应开始时烧杯中物质的质量。)
请计算,并回答下列有关问题:
(1)反应过程中产生的气体质量是 g。
(2)样品中碳酸钙的质量分数是多少?(写出计算过程,结果保留小数点后2位)
(1)3.3  (1分)
(1分)
(2)解:设碳酸钙的质量为x
CaCO3 + 2HCl === CaCl2 + H2O + CO2↑
100 44
x 3.3g
100:44=x:3.3g (1分) x=7.5g (1分)
碳酸钙的质量分数=7.5g÷8g×100%=93.75% (1分)
答:碳酸钙的质量分数为93.75% (1分)

练习册系列答案
相关题目
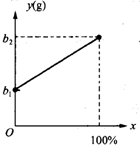 (2003?常州)有一种金属样品,可能由镁和锌中的一种或两种组成.现取一定质量的该金属样品与足量稀硫酸反应,镁在金属样品中的质量分数(x)与反应生成氢气的质量(y)为右图所示的一次函数关系.根据图象回答下列问题:
(2003?常州)有一种金属样品,可能由镁和锌中的一种或两种组成.现取一定质量的该金属样品与足量稀硫酸反应,镁在金属样品中的质量分数(x)与反应生成氢气的质量(y)为右图所示的一次函数关系.根据图象回答下列问题: 现有一瓶未开启的浓硫酸,试剂瓶标签上的部分内容如图所示.请根据有关信息回答并计算:
现有一瓶未开启的浓硫酸,试剂瓶标签上的部分内容如图所示.请根据有关信息回答并计算: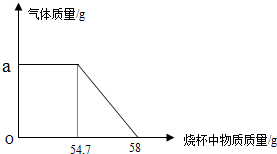 现有一种碳酸钙样品.为测定样品中碳酸钙的质量分数,实验小组进行了如下实验:
现有一种碳酸钙样品.为测定样品中碳酸钙的质量分数,实验小组进行了如下实验: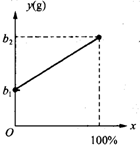 有一种金属样品,可能由镁和锌中的一种或两种组成.现取一定质量的该金属样品与足量稀硫酸反应,镁在金属样品中的质量分数(x)与反应生成氢气的质量(y)为右图所示的一次函数关系.根据图象回答下列问题:
有一种金属样品,可能由镁和锌中的一种或两种组成.现取一定质量的该金属样品与足量稀硫酸反应,镁在金属样品中的质量分数(x)与反应生成氢气的质量(y)为右图所示的一次函数关系.根据图象回答下列问题: