题目内容
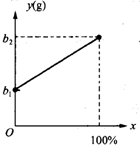 (2003?常州)有一种金属样品,可能由镁和锌中的一种或两种组成.现取一定质量的该金属样品与足量稀硫酸反应,镁在金属样品中的质量分数(x)与反应生成氢气的质量(y)为右图所示的一次函数关系.根据图象回答下列问题:
(2003?常州)有一种金属样品,可能由镁和锌中的一种或两种组成.现取一定质量的该金属样品与足量稀硫酸反应,镁在金属样品中的质量分数(x)与反应生成氢气的质量(y)为右图所示的一次函数关系.根据图象回答下列问题:(1)若该金属样品由纯镁组成,生成的氢气为
b2
b2
g.(2)若该金属样品由纯锌组成,生成的氢气为
b1
b1
g.(3)若该金属样品由等质量的镁和锌组成,生成氢气的质量为
| b1+b2 |
| 2 |
| b1+b2 |
| 2 |
(4)现有一定质量的碳酸钙和碳酸钠组成的混合物与足量稀盐酸反应,其中碳酸钙在混合物中的质量分数(z)与反应生成二氧化碳的质量(y)仍为上图所示的一次函数关系.若碳酸钙和碳酸钠质量相等,则生成二氧化碳的质量为
| b1+b2 |
| 2 |
| b1+b2 |
| 2 |
分析:(1)金属样品由纯镁组成即镁在金属样品中的质量分数(x)为100%,利用图示曲线查找样品中金属镁的质量分数为100%时生成氢气的质量的对应值;
(2)金属样品由纯锌组成即镁在金属样品中的质量分数(x)为0%,利用图示曲线查找样品中金属镁的质量分数为0%时生成氢气的质量的对应值;
(3)金属样品由等质量的镁和锌组成即镁在金属样品中的质量分数(x)为50%,利用图示曲线推断镁在金属样品中的质量分数为50%时,反应生成氢气的质量(y)的对应值;
(4)用横坐标表示碳酸钙在碳酸钙和碳酸钠组成的混合物中的质量分数(z)、而纵坐标表示反应生成二氧化碳的质量(y)时,利用曲线推断碳酸钙和碳酸钠质量相等即碳酸钙在混合物中的质量分数(z)为50%,生成二氧化碳的质量的对应值.
(2)金属样品由纯锌组成即镁在金属样品中的质量分数(x)为0%,利用图示曲线查找样品中金属镁的质量分数为0%时生成氢气的质量的对应值;
(3)金属样品由等质量的镁和锌组成即镁在金属样品中的质量分数(x)为50%,利用图示曲线推断镁在金属样品中的质量分数为50%时,反应生成氢气的质量(y)的对应值;
(4)用横坐标表示碳酸钙在碳酸钙和碳酸钠组成的混合物中的质量分数(z)、而纵坐标表示反应生成二氧化碳的质量(y)时,利用曲线推断碳酸钙和碳酸钠质量相等即碳酸钙在混合物中的质量分数(z)为50%,生成二氧化碳的质量的对应值.
解答:解:(1)若该金属样品由纯镁组成,即镁在金属样品中的质量分数(x)为100%,此时曲线对应的产生氢气质量为b2 ;
(2)若该金属样品由纯锌组成,即镁在金属样品中的质量分数(x)为0%,此时曲线对应的产生氢气质量为b1 ;
(3)若该金属样品由等质量的镁和锌组成,即镁在金属样品中的质量分数(x)为50%,此时曲线对应的产生氢气的点位于b2与b1 中间,该点的y值=b1 +
=
;
(4)若碳酸钙在混合物中的质量分数(z)与反应生成二氧化碳的质量(y)仍为上图所示的一次函数关系,则碳酸钙和碳酸钠质量相等即碳酸钙在混合物中的质量分数(z)为50%,此时曲线对应的产生二氧化碳的点位于b2与b1 中间,该点的y值=b1 +
=
;
故答案为:(1)b2 (2)b1 (3)
(4)
(2)若该金属样品由纯锌组成,即镁在金属样品中的质量分数(x)为0%,此时曲线对应的产生氢气质量为b1 ;
(3)若该金属样品由等质量的镁和锌组成,即镁在金属样品中的质量分数(x)为50%,此时曲线对应的产生氢气的点位于b2与b1 中间,该点的y值=b1 +
| b2-b1 |
| 2 |
| b1+b2 |
| 2 |
(4)若碳酸钙在混合物中的质量分数(z)与反应生成二氧化碳的质量(y)仍为上图所示的一次函数关系,则碳酸钙和碳酸钠质量相等即碳酸钙在混合物中的质量分数(z)为50%,此时曲线对应的产生二氧化碳的点位于b2与b1 中间,该点的y值=b1 +
| b2-b1 |
| 2 |
| b1+b2 |
| 2 |
故答案为:(1)b2 (2)b1 (3)
| b1+b2 |
| 2 |
| b1+b2 |
| 2 |
点评:根据变化关系曲线,利用横坐标所表示的混合物组成的比例,查找纵坐标所表示的产生气体的质量,此为解答该问题的主要方法.

练习册系列答案
 计算高手系列答案
计算高手系列答案
相关题目
