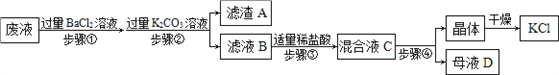
题目内容
【题目】将400g稀硫酸分4次加入20g铜铝合金中,产生氢气的情况如下:
次数 | 1 | 2 | 3 | 4 |
氢气质量/g | 0.5 | 0.5 | m | 0.3 |
求:(1)m的值为 g。
(2)铜铝合金中铜的质量分数
(3)稀硫酸中溶质的质量分数
【答案】(1)0.5 (2)19% (3)24.5%
【解析】根据反应原理及相关化学方程式分析解答。
(1)、由1、2两次反应可知每加入100g稀硫酸产生0.5g氢气且稀硫酸反应完。由第4次反应产生0.3g氢气可知第3次反应结束后铜铝合金有剩余。故m的值为0.5;
(2)、设合金中铝的质量为x。
2Al+3H2SO4= Al2(SO4)3+ 3H2↑
54 6
x ![]() 0.5g×3+0.3g=1.8g
0.5g×3+0.3g=1.8g
![]()
X=16.2g
合金中铜的质量为20g-16.2g=3.8g
合金中铜的质量分数为![]() 19%。
19%。
(3)、设第1次反应消耗硫酸的质量为y。
2Al+3H2SO4= Al2(SO4)3+ 3H2↑
294 6
y 0.5g
![]()
y=24.5g
稀硫酸中溶质的质量分数为:![]() =24.5%。
=24.5%。
答:稀硫酸中溶质的质量分数为24.5%。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目