题目内容
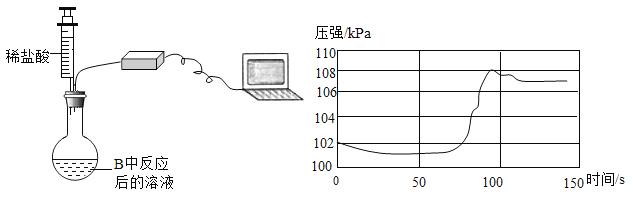
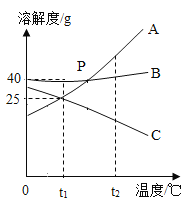
【题目】某化学兴趣小组同学欲运用所学知识和方法,分析某铁碳合金的组成。他们设计相关实验,并将实验过程用下图表述,请分析实验过程所给信息并结合计算回答以下问题: (钢的含碳量为0.03% ~2%,生铁的含碳量为2%~ 4.3%)
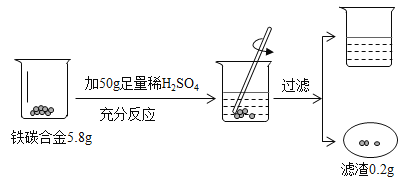
(1)铁碳合金属于 (填 “生铁”或“钢”)
(2)反应后烧杯中稀硫酸无剩余,请计算所用稀硫酸溶液中溶质的质量分数。
【答案】(1)生铁(2)19.6%
【解析】
(1)钢的含碳量为0.03% ~2%,生铁的含碳量为2%~ 4.3% 铁碳合金的含碳量为![]() ×100%≈3.4%,则铁碳合金属于生铁;
×100%≈3.4%,则铁碳合金属于生铁;
(2)由图可知50g稀硫酸充分反应,滤渣为0.2g,所以反应掉的铁为5.8g﹣0.2g=5.6g,设参加反应的稀硫酸溶质的质量为x,
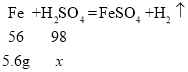
![]()
x=9.8g;
则稀硫酸溶液中溶质的质量分数=![]() ;
;
答:所加入的稀硫酸的溶质质量分数19.6%。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目