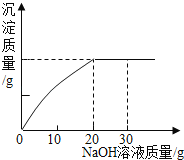
题目内容
【题目】某小组欲用质量分数为7.3%的盐酸测一瓶标签破损的NaOH溶液的质量分数.
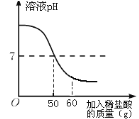
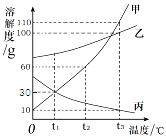
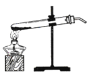
实验如下:取40g氢氧化钠溶液于烧杯中,然后把60g质量分数为7.3%的稀盐酸慢慢滴入到烧杯中,同时用电子pH计不断读取反应时的pH,得出如图所示的关系。求;
(1)该氢氧化钠溶液的溶质质量分数______。
(2)配制100g上述稀盐酸,需要质量分数为36.5%的浓盐酸多少克_______?
【答案】10% 20g
【解析】
(1)根据当溶液的pH值等于7时说明盐酸恰好和氢氧化钠溶液反应,消耗7.3%的盐酸的质量是50g进行解答;
(2)根据溶质质量相等进行解答。
解:(1)当溶液的pH值等于7说明盐酸恰好和氢氧化钠溶液反应,此时消耗7.3%的盐酸的质量是50g;设氢氧化钠的质量为x,
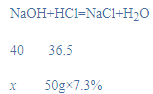
![]()
x=4g,
该氢氧化钠溶液的溶质质量分数是:![]() ×100%=10%;
×100%=10%;
(2)设所需质量分数为36.5%的盐酸溶液的质量为y,则:100g×7.3%=y×36.5%,y=20g;
答:(1)该氢氧化钠溶液的溶质质量分数是10%;
(2)所需质量分数为36.5%的盐酸溶液的质量为20g。

 天天练口算系列答案
天天练口算系列答案【题目】某兴趣小组在实验室中模拟炼铁化学原理的实验,对固体产物成分等进行探究。
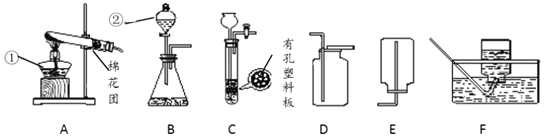
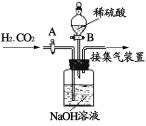
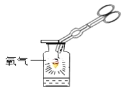
(设计实验)用一氧化碳还原纯净的氧化铁粉末,实验装置如下图。

(进行实验)该小组按上述实验设计,在一定温度下进行了实验。实验开始时,先向装置通一会儿一氧化碳,然后再加热,目的是_________。
实验过程中测得下列数据:
①反应前玻璃管和内盛氧化铁粉末的总质量66.0g(玻璃管的质量为60.0g)
②反应后玻璃管和内盛黑色固体的总质量65.8g(冷却到室温称量)
(分析与讨论)
本实验中,玻璃管内固体粉末由红色全部变为黑色.小明同学认为该黑色固体全部是铁,但小华同学提出了质疑,于是大家提出查阅资料.
(查阅资料)
①一氧化碳还原氧化铁的固体产物的成分与反应温度、反应时间等因素有关。
②一氧化碳还原氧化铁的实验过程中固体产物可能有四氧化三铁、氧化亚铁、铁。
物质性质 | 四氧化三铁 | 氧化亚铁 | 氧化铁 | 铁粉 |
颜色 | 黑色 | 黑色 | 红色 | 黑色 |
能否被磁铁吸引 | 能 | 不能 | 不能 | 能 |
(实验与猜想)
(1)该小组同学将反应后的黑色固体研磨后,再用磁铁吸引,发现黑色固体粉末全部能被吸引,则该黑色固体粉末中不可能含有氧化铁和 ____________。
(2)进行猜想:黑色固体粉末可能有三种:
a.全部为铁 b.全部为四氧化三铁c._________。
(3)通过实验中获得的数据进行计算,得出结论:猜想 _________。
(填“a”“b”或“c”)正确.
(4)实验装置图中采用虚线框内的装置,其作用有 ___________。
A.收集一氧化碳 B.吸收二氧化碳 C.检验二氧化碳.