题目内容
【题目】铬(Cr)是硬度最大的金属。某实验小组为了探究Cr与铁、铜的活动性强弱,进行如下实验:
(猜想与假设)猜想1.Cr>Fe>Cu;
猜想2._____
猜想3. Fe>Cu>Cr
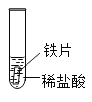
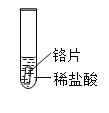
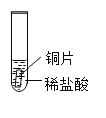
(实验与事实)取大小相等的三种金属片,用砂纸打磨光亮;再取三支试管,分别放入等量的同浓度稀盐酸。
实验 | 试管1 | 试管2 | 试管3 |
实验操作 |
|
|
|
实验现象 | 铁片表面产生气泡较慢,溶液变为浅绿色 | 铬片表面产生气泡较快,溶液变为蓝色 | _____ |
(解释与结论)
根据实验现象,则猜想_____成立。
(反思与评价)
实验前用砂纸打磨金属片的目的是_____。
(表达与交流)
写出试管1中发生反应的化学方程式_____。
(拓展与迁移)
若只有一支盛有稀盐酸的试管,只需合理安排金属片(己打磨)的插入顺序(能与稀盐酸反应的一次将盐酸消耗完全),也能证明铬、铁、铜这三种金属的活动性顺序,则三种金属片的插入顺序为_____。
【答案】Fe>Cr>Cu 无明显现象 1 除去金属表面的氧化膜 ![]() 铜、铁、铬(答案合理即可)
铜、铁、铬(答案合理即可)
【解析】
猜想与假设:猜想1.Cr>Fe>Cu;
猜想2.Fe>Cr>Cu
猜想3. Fe>Cu>Cr
实验与事实:金属活动顺序铜位于氢的后面,试管3中,铜片与稀盐酸不反应,无明显现象;
解释与结论:
根据试验现象:铬片表面产生气泡较快,溶液变为蓝色,铁片表面产生气泡较慢,溶液变为浅绿色,铜片与稀盐酸不反应,无明显现象;
金属活动性:Cr>Fe>Cu
则猜想1成立;
反思与评价:实验前用砂纸打磨金属片的目的是:除去金属表面的氧化膜,防止干扰实验;
表达与交流:试管1中铁与稀盐酸反应产生氯化铁和氢气的化学方程式:Fe+2HCl=FeCl2+H2↑;
拓展与迁移:若只有一支盛有稀盐酸的试管,只需合理安排金属片的插入顺序也能证明铬、铁、铜这三种金属的活动性顺序,则现将铜加入稀盐酸中,不反应,则说明:氢大于铜,再将铁插入稀盐酸中,有气泡产生,说明铁大于氢,将铬插入氯化亚铁的溶液中,溶液由浅绿色逐渐变为蓝色,说明铬大于铁;则三种金属片的插入顺序为:铜、铁、铬。

 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案 一线名师权威作业本系列答案
一线名师权威作业本系列答案