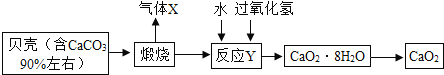
题目内容
【题目】黄铁矿的主要成分为二硫化亚铁(FeS2),工业上可利用黄铁矿煅烧的产物冶炼铁和生产浓硫酸,其工业流程如图:
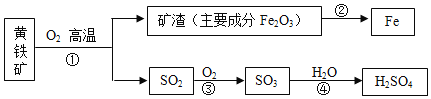
(1)O2可以从空气分离得到,空气属于_____________ (填“纯净物” 或“混合物”)。
(2)用CO还原Fe2O3制单质铁,反应的化学方程式为_________________;冶炼200t含Fe2O380%的矿渣,理论上能得到含杂质2%的生铁的质量是___________________t (结果精确到0.1)。
(3)该工业生产过程产生的废气中的SO2可以用__________________溶液吸收,写出反应的化学方程式__________________;若不对其作吸收处理,溶于雨水后会形成___________________。
【答案】混合物  114.3 氢氧化钙(合理即可)
114.3 氢氧化钙(合理即可) ![]() 酸雨
酸雨
【解析】
(1)空气是由氮气、氧气等两种以上物质混合而成的,属于混合物;
(2)一氧化碳与三氧化二铁在高温的条件下反应生成铁和二氧化碳,该反应的化学方程式为: ;
;
解:设冶炼200t含Fe2O380%的矿渣,理论上能得到含杂质2%的生铁的质量是x

![]() x≈114.3t
x≈114.3t
(3)该工业生产过程产生的废气中的SO2可以用氢氧化钙溶液吸收;
氢氧化钙能与二氧化硫反应生成亚硫酸钙和水,该反应的化学方程式为:![]() ;
;
若不对其作吸收处理,溶于雨水后会形成:酸雨。

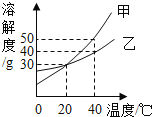
【题目】下表是NaCl、 KClO3在不同温度下的溶解度(单位: g)
温度(°C) | 0 | 20 | 40 | 60 | 80 | 100 |
S(NaC1) | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 | 39.8 |
S(KClO3) | 3.3 | 7.3 | 13.9 | 23.8 | 37.5 | 56.3 |
(1)20°C时,NaCl的溶解度为________;
(2)40°C时,将10gKClO3放入100g水中充分溶解,所得溶液溶质质量分数为________;(精确到0.1% )
(3)“海水晒盐”利用的方法是__________;(填“蒸发结晶”或“降温结晶”) ;
(4)实验室可以用加热一定质量的氯酸钾与二氧化锰的混合物制取氧气,根据需要产生9.6g氧气后停止加热,则发生反应的氯酸钾的质量为________g.反应后剩余固体的成分可能为________。
(5)工业上用氯化钠溶液制备氯酸钾,主要流程如下:
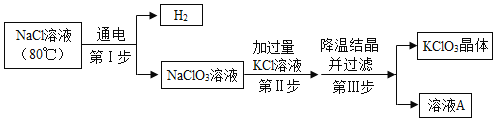
(第II步中发生的反应: ![]() )
)
①第I步反应的化学方程式为_________。
②溶液A中含有的溶质有__________(填化学式) .
【题目】根据下表信息,相关说法正确的是
温度/°C | 20 | 30 | 40 | 60 | |
溶解度/g | KCl | 34.0 | 37.0 | 40 | 42.6 |
NaNO3 | 88.2 | 96.5 | 102.1 | 125.5 | |
A.NaNO3是易溶物质,KCl是可溶物质
B.40°C时,5gKCl加入10g水中可得浓度为33.3%的KCl溶液
C.除去NaNO3固体中的少量KCl,通常采用溶解降温结晶的方法
D.将60°C时NaNO3和KCl的饱和溶液分别降温至20°C,析出晶体较多的是NaNO3溶液