题目内容
【题目】某工厂排放的废水中含有NaOH和Na2CO3 , 为了测定废水中NaOH的质量分数,取废水100g逐滴加入稀盐酸至过量,测得生成气体的质量与所加稀盐酸的质量关系如图所示。试计算: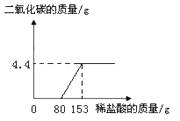
(1)当所取样品完全反应时,生成气体的质量为g。
(2)恰好完全反应时所得溶液的溶质质量分数。
【答案】
(1)4.4
(2)解:根据质量守恒定律,恰好完全反应时所得溶液的溶质为:100g+153g-4.4g=248.6g,与碳酸钠反应的稀盐酸溶液的质量是:153-80=73(g) ,与氢氧化钠反应的稀盐酸溶液的质量是:80g,设碳酸钠与稀盐酸反应生成氯化钠的质量是x,氢氧化钠与稀盐酸反应生成氯化钠的质量是y,稀盐酸的溶质质量分数为w
Na2CO3+ | 2HCl= | 2NaCl+H2O+ | CO2↑ |
106 | 117 | 44 | |
73g×w | x | 4.4g |
![]() =
= ![]() 解得w=10%;
解得w=10%;
![]() =
=![]() 解得x=11.7g;
解得x=11.7g;
NaOH+ | HCl = | NaCl+H2O |
36.5 | 58.5 | |
10%×80g | y |
![]() =
=![]() 解得y=12.8g;
解得y=12.8g;
恰好完全反应时所得溶液的溶质质量是:11.7g+12.8g=24.5g;
恰好完全反应时所得溶液的溶质质量分数是:24.5g÷248.6g≈9.9%。
【解析】解:(1)根据图像所表示的化学信息,生成二氧化碳气体的质量是4.4g。
所以答案是:(1)4.4;(2)9.9%。
【考点精析】通过灵活运用质量守恒定律及其应用和根据化学反应方程式的计算,掌握①质量守恒定律只适用于化学变化,不适用于物理变化;②不参加反应的物质质量及不是生成物的物质质量不能计入“总和”中;③要考虑空气中的物质是否参加反应或物质(如气体)有无遗漏;各物质间质量比=系数×相对分子质量之比即可以解答此题.

 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案【题目】张华同学对酸、碱、盐的知识进行了以下的梳理。
(1)填写下表空格中的化学式。
氯化钾 | 氯化钙 | 氯化钠 | 氯化镁 | 氯化铝 | 氯化锌 | 氯化亚铁 | 氯化铜 |
KCl | CaCl2 | NaCl | MgCl2 | ZnCl2 | FeCl2 |
思考:根据以上盐中的金属元素的排列,可以得出他是依据顺序归纳整理的。
(2)为理解稀盐酸和氢氧化钠两者之间发生反应的微观实质,绘制了如图。请你在右边的圆圈中填入适当的化学式或离子符号: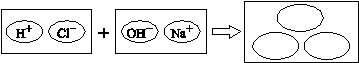
(3)张华同学发现酸、碱、盐之间的反应都有盐类物质生成。请写出一个能生成MgCl2的复分解反应的化学方程式:。
(4)我们知道溶液酸碱度pH可显示的溶液的酸碱性;酸溶液pH<7,溶液显酸性;碱溶液pH>7,溶液显碱性.提出问题:盐溶液的pH怎样呢?盐溶液显什么性呢?
猜想与假设:盐溶液的pH可能为:pH=7、pH<7、pH>7.
设计与实验:下列是两同学分别对相同的NaCl溶液、CuSO4溶液、K2CO3溶液的pH进行的测定实验:甲同学:取pH试纸放在玻片上,用玻棒蘸取测试液滴在pH试纸上,试纸显色后与pH标准比色卡比较.乙同学:取pH试纸放在玻片上,用蒸馏水将pH试纸润湿,再用玻棒蘸取测试液滴在pH试纸上,试纸显色后与pH标准比色卡比较.
记录数据:下表是两同学记录所测pH的实验数据:
NaCl溶液 | CuSO4溶液 | K2CO3溶液 | |
甲同学 | 7 | 4 | 10 |
乙同学 | 7 | 5 | 9 |
结论:通过测定几种盐溶液的pH,可以得出的结论是: .
评价与反思:上述两同学测得的数据,反映了溶液真实pH的是同学。