题目内容
(2012?株洲模拟)取含杂质的锌粒6.5g跟足量的稀硫酸反应,得到0.21g氢气,则杂质不可能是( )
分析:假设样品中全部是锌,计算一下6.5g锌能产生多少氢气,再与0.21g作比较,若计算值比0.21g大,说明混有的金属产生氢气的能力不如锌,或者说根本就不会产生氢气;若计算值比0.21g小,说明混有的金属产生氢气的能力比锌强.
解答:解:假设该样品全部是锌,则生成氢气的量为x
Zn+H2SO4=ZnSO4+H2↑
65 2
6.5g x
=
x=0.2g
可见此样品中混有的物质产生氢气的能力比锌强.
相同量的ABC产生氢气的能力都比锌强,所以只有D符合题意.
故选D.
Zn+H2SO4=ZnSO4+H2↑
65 2
6.5g x
| 65 |
| 6.5g |
| 2 |
| x |
x=0.2g
可见此样品中混有的物质产生氢气的能力比锌强.
相同量的ABC产生氢气的能力都比锌强,所以只有D符合题意.
故选D.
点评:相同的一道题可以有多种解法,同学们要会快速的用简便的方法按要求计算,如本题用的就是假设法,也可以用平均值法.

练习册系列答案
相关题目
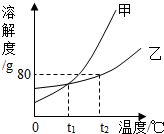 (2012?株洲模拟)如图所示是甲、乙两种固体物质的溶解度曲线,请回答下列问题:
(2012?株洲模拟)如图所示是甲、乙两种固体物质的溶解度曲线,请回答下列问题: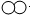 ”和“
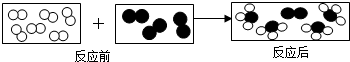
”和“ ”代表两种不同的单质分子,它们在一定条件下能发生化学反应,反应前后的微观示意图如图所示,下列说法正确的是( )
”代表两种不同的单质分子,它们在一定条件下能发生化学反应,反应前后的微观示意图如图所示,下列说法正确的是( )