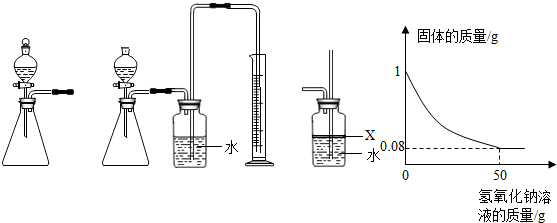
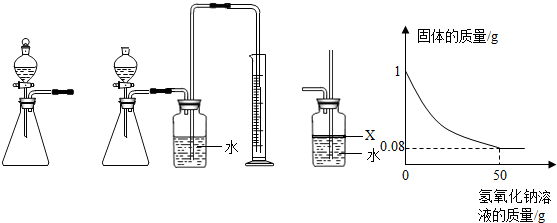
题目内容
学习化学是为了应用化学,造福人类.I.化学知识将在2008年北京奥运会的多个方面发挥重要的作用.
(1)举重运动员在抓杠铃前常擦一种白色粉末碳酸镁(MgCO3),则碳酸镁属于 (填序号);
A.酸 B.碱 C.盐 D.氧化物
(2)今年5月11日,奥运圣火来到福建,据悉奥运火炬的燃料为丙烷.请根据下表信息写出丙烷的化学式:;
| 物质 | 甲烷 | 乙烷 | 丙烷 | 丁烷 | 戊烷 |
| 化学式 | CH4 | C2H6 | C4 H10 | C5 H12 |
A.导热、导电性
B.耐腐蚀、硬度较大、密度小
C.有金属光泽、良好的延展性
Ⅱ.汶川大地震是新中国成立以来破坏性最强的一次地震.灾后防疫部门用2%的漂白粉溶液对环境进行喷洒杀菌消毒.现代工业采用把氯气和消石灰或石灰乳反应的方法制取漂白粉.
(1)已知反应的化学方程式为2Cl2+2Ca(OH)2═X+Ca(C10)2+2H2O,则X的化学式为 ;
(2)商品漂白粉中含有Ca(ClO)2、Ca(OH)2、CaCl2等物质,其中有效成分是Ca(C1O)2,因此商品漂白粉是 (填“混合物”或“纯净物”);
(3)在化学反应中,物质所含元素的化合价发生变化的就是氧化还原反应.根据(1)化学方程式中的Cl元素化合价变化情况判断该反应 (填“是”或“不是”)氧化还原反应;
(4)汶川大地震使当地居民的饮用水受污染,以下关于饮用水处理方法不合理的是(填序号).
A.用明矾使悬浮物沉降下来
B.用漂白粉进行消毒杀菌
C.只要无色透明的水就可以放心饮用
D.饮用前加热煮沸.
【答案】分析:I.(1)电离时生成的阳离子都是氢离子的化合物是酸,电离时生成的阴离子都是氢氧根离子的化合物是碱,由金属离子和酸根离子组成的化合物属于盐.
(2)根据烷类的书写规则书写丙烷化学式;
(3)根据铝合金的性质分析;
Ⅱ.(1)根据质量守恒定律:在化学反应中,反应前后原子的种类没有改变,数目没有增减;进行解答;
(2)根据混合物的概念分析,由多种物质组成的物质属于混合物;
(3)根据题中提供的信息结合化合价的变化进行分析;
(4)A、明矾溶于水后可促进水中悬浮杂质的沉降;
B、漂白粉具有杀菌消毒的功能;
C、无色透明的水不一定符合饮用水标准;
D、加热煮沸既可以消毒,又可以软化水.
解答:解:I.(1)碳酸镁是由镁离子和碳酸根离子组成的化合物,属于盐;
(2)根据题中信息可知,烷类的命名是根据一个分子中碳原子的个数是1、2、3…,命名为甲烷、乙烷、丙烷…
,还可以知道一个分子中氢原子的个数是碳原子个数的2倍加上2,因此丙烷的化学式为C3H8;
(3)奥运火炬采用铝合金制作,其最主要是利用铝合金的耐腐蚀、硬度较大、密度小;
Ⅱ.(1)根据质量守恒定律:在化学反应中,反应前后原子的种类没有改变,数目没有增减;由反应的化学方程式,反应物中Cl、Ca、O、H原子个数分别为4、2、4、4,反应后的生成物中除X外Cl、Ca、O、H原子个数分别为2、1、4、4,则X中含有2个Cl原子和1个Ca原子,则X的化学式为:CaCl2;
(2)商品漂白粉中含有Ca(ClO)2、Ca(OH)2、CaCl2等多种物质,因此商品漂白粉是混合物;
(3)2Cl2+2Ca(OH)2═CaCl2+Ca(C10)2+2H2O,该反应的反应物氯气中氯元素的化合价为零,生成物氯化钙中氯元素的化合价是-1价,根据在化学反应中,物质所含元素的化合价发生变化的就是氧化还原反应可知,该反应属于氧化还原反应;
(4)A、净化水时,明矾溶于水后可促进水中悬浮杂质的沉降,故正确;
B、用漂白粉可以对水进行杀菌消毒,故正确;
C、无色透明的水中可能含有过多的钙离子、镁离子,水中的钙离子和镁离子过多时对人体健康不利,故错误;
D、饮用前加热煮沸可以消毒,也可以软化水,故正确.
故答案为:I.(1)C;(2)C3H8;(3)B;
Ⅱ.(1)CaCl2;(2)混合物;(3)是;(4)C.
点评:本题考查的知识点很多,只有根据所学的知识逐一进行分析即可解决,同时考查了学生根据题中信息结合所学知识分析、解决问题的能力,难度不大.
(2)根据烷类的书写规则书写丙烷化学式;
(3)根据铝合金的性质分析;
Ⅱ.(1)根据质量守恒定律:在化学反应中,反应前后原子的种类没有改变,数目没有增减;进行解答;
(2)根据混合物的概念分析,由多种物质组成的物质属于混合物;
(3)根据题中提供的信息结合化合价的变化进行分析;
(4)A、明矾溶于水后可促进水中悬浮杂质的沉降;
B、漂白粉具有杀菌消毒的功能;
C、无色透明的水不一定符合饮用水标准;
D、加热煮沸既可以消毒,又可以软化水.
解答:解:I.(1)碳酸镁是由镁离子和碳酸根离子组成的化合物,属于盐;
(2)根据题中信息可知,烷类的命名是根据一个分子中碳原子的个数是1、2、3…,命名为甲烷、乙烷、丙烷…
,还可以知道一个分子中氢原子的个数是碳原子个数的2倍加上2,因此丙烷的化学式为C3H8;
(3)奥运火炬采用铝合金制作,其最主要是利用铝合金的耐腐蚀、硬度较大、密度小;
Ⅱ.(1)根据质量守恒定律:在化学反应中,反应前后原子的种类没有改变,数目没有增减;由反应的化学方程式,反应物中Cl、Ca、O、H原子个数分别为4、2、4、4,反应后的生成物中除X外Cl、Ca、O、H原子个数分别为2、1、4、4,则X中含有2个Cl原子和1个Ca原子,则X的化学式为:CaCl2;
(2)商品漂白粉中含有Ca(ClO)2、Ca(OH)2、CaCl2等多种物质,因此商品漂白粉是混合物;
(3)2Cl2+2Ca(OH)2═CaCl2+Ca(C10)2+2H2O,该反应的反应物氯气中氯元素的化合价为零,生成物氯化钙中氯元素的化合价是-1价,根据在化学反应中,物质所含元素的化合价发生变化的就是氧化还原反应可知,该反应属于氧化还原反应;
(4)A、净化水时,明矾溶于水后可促进水中悬浮杂质的沉降,故正确;
B、用漂白粉可以对水进行杀菌消毒,故正确;
C、无色透明的水中可能含有过多的钙离子、镁离子,水中的钙离子和镁离子过多时对人体健康不利,故错误;
D、饮用前加热煮沸可以消毒,也可以软化水,故正确.
故答案为:I.(1)C;(2)C3H8;(3)B;
Ⅱ.(1)CaCl2;(2)混合物;(3)是;(4)C.
点评:本题考查的知识点很多,只有根据所学的知识逐一进行分析即可解决,同时考查了学生根据题中信息结合所学知识分析、解决问题的能力,难度不大.

练习册系列答案
 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案
相关题目
 海洋资源十分丰富.
海洋资源十分丰富.(1)海水晒盐可获得粗盐,在实验室中粗盐经过溶解、过滤、
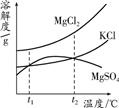
(2)晒盐后得到的卤水中含有MgCl2、KCl和MgSO4等物质,
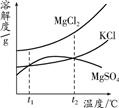
如图是它们的溶解度曲线示意图.设t1℃时MgCl2、KCl和MgSO4三种物质的溶解度大小
关系为
(3)目前世界上60%的镁是从海水中提取的.其主要步骤如下:
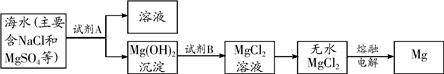
①提取Mg的过程中,试剂B选用
由无水MgCl2制取Mg的化学反应方程式为
在此过程中
②镁是重要的金属材料,广泛应用于合金、火箭和飞机制造业.镁是一种较活泼金属,在二氧化碳气体中也能燃烧.燃烧的化学方程式为:2Mg+C02═C+2MgO,反应类型属于
A.分解反应 B.化合反应 C.置换反应 D.复分解反应
金属镁在高温下与氮气反应生成氮化镁,在氮化镁中氮元素的化合价为-3.据此写出该反应的化学方程式
| 实验序号 | 第一次实验 | 第二次实验 | 第三次实验 |
| 所取海水质量/kg | 100 | 100 | 100 |
| 生成沉淀质量/kg | 0.28 | 0.29 | 0.30 |
③分离出Mg(OH)2后的NaCl溶液中还含有杂质CaCl2、Na2SO4,为了获得NaCl溶液,在分离后的溶液中依次加入过量的BaCl2溶液和Na2CO3溶液,过滤,再向滤液中加入适量盐酸.实验中加入过量BaCl2溶液是为了
 海洋资源十分丰富.
海洋资源十分丰富.
(1)海水晒盐可获得粗盐,在实验室中粗盐经过溶解、过滤、________等步骤可制得精盐.上述过程所用的主要玻璃仪器有:a烧杯、b玻璃棒、c________、d________.
(2)晒盐后得到的卤水中含有MgCl2、KCl和MgSO4等物质,
如图是它们的溶解度曲线示意图.设t1℃时MgCl2、KCl和MgSO4三种物质的溶解度大小
关系为________.
(3)目前世界上60%的镁是从海水中提取的.其主要步骤如下:

①提取Mg的过程中,试剂B选用________,
由无水MgCl2制取Mg的化学反应方程式为________.
在此过程中________能转化为________能.
②镁是重要的金属材料,广泛应用于合金、火箭和飞机制造业.镁是一种较活泼金属,在二氧化碳气体中也能燃烧.燃烧的化学方程式为:2Mg+C02═C+2MgO,反应类型属于________
A.分解反应 B.化合反应 C.置换反应 D.复分解反应
金属镁在高温下与氮气反应生成氮化镁,在氮化镁中氮元素的化合价为-3.据此写出该反应的化学方程式________.世界上大部分镁是从海水中提取的.某校学习小组的同学对家乡附近海水中镁元素的含量进行测定.称取海水100kg,然后再加入足量的试剂A,过滤、洗涤、干燥后称量得到沉淀质量见下表(重复实验三次).
| 实验序号 | 第一次实验 | 第二次实验 | 第三次实验 |
| 所取海水质量/kg | 100 | 100 | 100 |
| 生成沉淀质量/kg | 0.28 | 0.29 | 0.30 |
③分离出Mg(OH)2后的NaCl溶液中还含有杂质CaCl2、Na2SO4,为了获得NaCl溶液,在分离后的溶液中依次加入过量的BaCl2溶液和Na2CO3溶液,过滤,再向滤液中加入适量盐酸.实验中加入过量BaCl2溶液是为了________;加入过量Na2CO3溶液的目的是________.