题目内容
质量守恒定律是物质发生化学变化所遵循的一项基本规律。
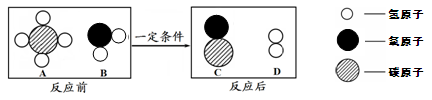
(1)1774年,拉瓦锡将45.0份质量的氧化汞加热分解,恰好得到了41.5份质量的汞和3.5份质量的氧气,反应前后各物质的质量总和没有改变。
①该反应的化学方程式为 。
②从微观角度解释反应前后各物质的质量总和没有改变的原因:
。
(2)为了验证质量守恒定律,甲、乙、丙三位同学各做了一个实验。
①甲同学测定的数据有:木炭和坩埚的总质量m g,木炭充分灼烧后的灰烬和坩埚的总质量n g,m和n的关系为m n (选填“>”、“<”或“=”)。
②乙同学测定的数据有:铜片的质量x g,铜片充分加热后的质量y g,x和y的关系为x y(选填“>”、“<”或“=”)。
③丙同学测定的数据有:铁钉、硫酸铜溶液和烧杯的总质量a g,铁钉、硫酸铜溶液充分反应后的混合物和烧杯的总质量 b g,a和b的关系为a b(选填“>”、“<”或“=”)。
④上述实验所涉及的化学反应中,符合质量守恒定律的是 (选填“甲”、“乙”、“丙”)。
(1)①2HgO 2Hg+O2↑
2Hg+O2↑
②在化学反应中,反应前后原子的种类没有改变,数目没有增减,原子的质量也没有改变
(2)①> ②< ③= ④甲、乙、丙
解析试题分析:(1)化学反应的本质是分子的破裂和原子的重新组合,在这一过程中,原子的种种类、数目、质量都不发和改变,故化学反应前后质量是守恒的。
(2)甲同学的实验没有将生成的二氧化碳气体及参与反应的氧气计算在内,故反应前后质量不相等。不管反应物、生成物是气体、固体还是液体,质量守恒定律要求将所有的反应物、生成物的质量全部计算在内,反应前后质量总和才会相等。可见,表面看质量不相等,但实质质量仍然是守恒的。乙同学与甲同学原因相似,质量也是守恒的。
考点:质量守恒定律的深入理解

(9分)(2013?安庆一模)小雨阅读课外资料得知:氯酸钾的分解可用二氧化锰、氧化铜等物质作催化剂.于是,他对影响氯酸钾分解的因素及催化剂的催化效果产生了探究兴趣.
【提出问题】氧化铜是否比二氧化锰催化效果更好?影响氯酸钾分解速率的因素有哪些呢?
【设计实验】小雨以生成等体积的氧气为标准,设计了下列几组实验.
| 序号 | KClO3的质量 | 其他物质的质量 | 温度 | 氧气的体积 | 反应所需时间 |
| ① | 2.0g | | 330℃ | 100mL | t1 |
| ② | 2.0g | CuO 0.5g | 330℃ | 100mL | t2 |
| ③ | 2.0g | MnO2 0.5g | 330℃ | 100mL | t3 |
| ④ | 2.0g | MnO2 _________ g | 380℃ | 100mL | t4 |
(2)你认为小雨设计实验③和实验②对比的目的是 _________ .
(3)实验④中MnO2的质量为 _________ g,若t3>t4,则化学反应快慢与温度的关系是 _________ .
(4)写出实验④所涉及的化学方程式 _________ .
乙醇的分子结构模型如图所示,则下列叙述正确的是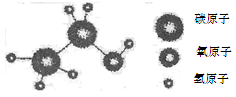
| A.乙醇是由三种元素组成的混合物 |
| B.一个乙醇分子中含有7个原子 |
| C.乙醇中碳、氧元素的质量比为3∶2 |
| D.乙醇中氧元素的质量分数最大 |
氧气是空气的主要成分之一,有关氧气的说法错误的是( )
| A.带火星的木条可以检验氧气 |
| B.氧气的化学性质比氮气活泼 |
| C.鱼类能在水中生存说明氧气易溶于水 |
| D.在常温下,氧气也能与有些物质发生反应 |