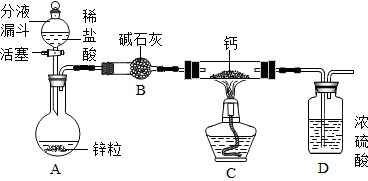
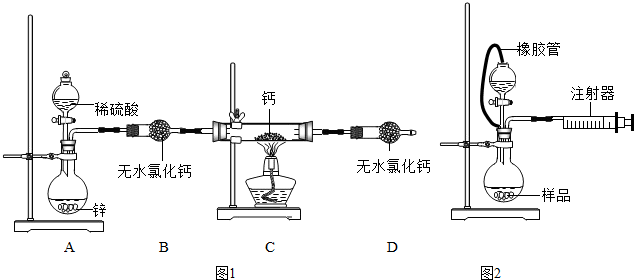
题目内容
氢化钙(CaH2)固体是登山队员常用的能源提供剂,用它与水反应生成氢氧化钙〔Ca(OH)2〕和氢气,氢气供燃烧之需,现有84g氢化钙与足量水反应,可生成多少克H2?
解:设84g氢化钙与足量水反应生成氢气的质量为x
CaH2+2H2O═Ca(OH)2+2H2↑
42 4
84g x
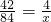
x=8g
答:84g氢化钙与足量水反应可生成氢气8g.
分析:根据氢化钙与水反应生成氢氧化钙和氢气的反应化学方程式可表示反应中各物质的质量关系,可利用参加反应的氢化钙的质量计算出生成的氢气的质量.
点评:反应的化学方程式能表示出反应中各物质的质量比,根据物质的质量比,可由反应中任一物质的质量计算出反应中其它物质的质量.
CaH2+2H2O═Ca(OH)2+2H2↑
42 4
84g x
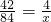
x=8g
答:84g氢化钙与足量水反应可生成氢气8g.
分析:根据氢化钙与水反应生成氢氧化钙和氢气的反应化学方程式可表示反应中各物质的质量关系,可利用参加反应的氢化钙的质量计算出生成的氢气的质量.
点评:反应的化学方程式能表示出反应中各物质的质量比,根据物质的质量比,可由反应中任一物质的质量计算出反应中其它物质的质量.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
(本题有a、b两小题,考生任选一题解答,不得两题都解.若两题都解,则以a小题计分)
a.2005年5月22日上午11时08分,中国登山测量队成功登上珠峰顶,这是继1975年后我国再次对珠穆朗玛峰高度进行精确测量.氢化钙(CaH2)固体是登山队员常用的能源提供剂,用它和水反应生成氢氧化钙和氢气:CaH2+2H2O═Ca(OH)2+2H2↑氢气供燃烧之需.现有84g氢化钙与足量水反应,可生成多少克氢气?
b.为了测定某铜锌合金(即铜锌混合物)中锌的质量分数,某同学利用该合金与稀硫酸
反应,进行了三次实验,所得相关的实验数据记录如下(实验中的误差忽略不计):
(1)试计算该铜锌合金中锌的质量分数?
(2)从上表数据分析,当所取合金与所用稀硫酸的质量比为 时,表明合金中的锌与稀硫酸中的硫酸恰好完全反应;
(3)在哪几次反应中硫酸有剩余? .
a.2005年5月22日上午11时08分,中国登山测量队成功登上珠峰顶,这是继1975年后我国再次对珠穆朗玛峰高度进行精确测量.氢化钙(CaH2)固体是登山队员常用的能源提供剂,用它和水反应生成氢氧化钙和氢气:CaH2+2H2O═Ca(OH)2+2H2↑氢气供燃烧之需.现有84g氢化钙与足量水反应,可生成多少克氢气?
b.为了测定某铜锌合金(即铜锌混合物)中锌的质量分数,某同学利用该合金与稀硫酸
反应,进行了三次实验,所得相关的实验数据记录如下(实验中的误差忽略不计):
| 第一次 | 第二次 | 第三次 | |
| 所取合金的质量∕g | 25 | 25 | 50 |
| 所用稀硫酸的质量∕g | 120 | 160 | 100 |
| 生成氢气的质量∕g | 0.4 | 0.4 | 0.4 |
(2)从上表数据分析,当所取合金与所用稀硫酸的质量比为
(3)在哪几次反应中硫酸有剩余?