题目内容
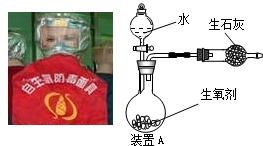 图是一种“化学氧自救器”(又称“自生氧防毒面具”),其使用的生氧剂(主要成分是KO2)的作用原理为:4KO2+2CO2=2K2CO3+3O2.某研究小组取100g生氧剂,放入装置A中,加入足量水与生氧剂充分反应(化学方程式为:4KO2+2H2O=4KOH+3O2↑),测定反应前后装置A的总质量(装置中的生石灰可防止因反应放热汽化的水蒸气从装置中逸出),他们进行了三次实验.测定结果如下
图是一种“化学氧自救器”(又称“自生氧防毒面具”),其使用的生氧剂(主要成分是KO2)的作用原理为:4KO2+2CO2=2K2CO3+3O2.某研究小组取100g生氧剂,放入装置A中,加入足量水与生氧剂充分反应(化学方程式为:4KO2+2H2O=4KOH+3O2↑),测定反应前后装置A的总质量(装置中的生石灰可防止因反应放热汽化的水蒸气从装置中逸出),他们进行了三次实验.测定结果如下
| 测定序号 | 第1次 | 第2次 | 第3次 | 平均值 |
| 反应前装置A总质量(g) | 400.1 | 400.2 | 399.7 | 400.O |
| 反应后装置A总质量(g) | 368.1 | 368.1 | 367.8 | 368.O |
(1)100g生氧剂与足量水反应生成的氧气质量;
(2)生氧剂中KO2的质量分数;(保留到0.1%)
分析:根据题意可知,生氧剂与水反应前后的质量差为反应放出氧气的质量;
每次称重时都会出现一定的误差,因此使用三次称重的平均值计算氧气质量更科学更准确.
每次称重时都会出现一定的误差,因此使用三次称重的平均值计算氧气质量更科学更准确.
解答:解:(1)100g生氧剂与足量水反应生成的氧气质量=400g-368g=32g;(2分)
(2)设生成32g氧气消耗KO2的质量为x
4KO2+2H2O=4KOH+3O2↑
284 96
x 32g
284:96=x:32g
解之得 x≈94.7g
生氧剂中KO2的质量分数=
×100%=94.7%;
答:(1)100g生氧剂与足量水反应生成的氧气质量为32g;
(2)生氧剂中KO2的质量分数约为94.7%.
(2)设生成32g氧气消耗KO2的质量为x
4KO2+2H2O=4KOH+3O2↑
284 96
x 32g
284:96=x:32g
解之得 x≈94.7g
生氧剂中KO2的质量分数=
| 94.7g |
| 100g |
答:(1)100g生氧剂与足量水反应生成的氧气质量为32g;
(2)生氧剂中KO2的质量分数约为94.7%.
点评:题中反应4KO2+2CO2=2K2CO3+3O2为干扰信息,计算时与此反应无关.

练习册系列答案
 快乐5加2金卷系列答案
快乐5加2金卷系列答案
相关题目
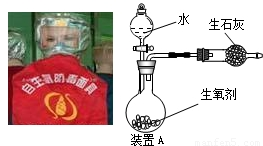
图是一种“化学氧自救器”(又称“自生氧防毒面具”),其使用的生氧剂(主要成分是KO2)的作用原理为:4KO2+2CO2=2K2CO3+3O2.某研究小组取100g生氧剂,放入装置A中,加入足量水与生氧剂充分反应(化学方程式为:4KO2+2H2O=4KOH+3O2↑),测定反应前后装置A的总质量(装置中的生石灰可防止因反应放热汽化的水蒸气从装置中逸出),他们进行了三次实验.测定结果如下
请根据上述实验结果计算:(假设杂质不与水反应产生气体)
(1)100g生氧剂与足量水反应生成的氧气质量;
(2)生氧剂中KO2的质量分数;(保留到0.1%)
| 测定序号 | 第1次 | 第2次 | 第3次 | 平均值 |
| 反应前装置A总质量(g) | 400.1 | 400.2 | 399.7 | 400.O |
| 反应后装置A总质量(g) | 368.1 | 368.1 | 367.8 | 368.O |
(1)100g生氧剂与足量水反应生成的氧气质量;
(2)生氧剂中KO2的质量分数;(保留到0.1%)