题目内容
【题目】大多矿泉水瓶的标签上印有如下字样:Ca≥4.0mg/L、Mg≥0.5mg/L、K≥0.35mg/L、Na≥0.8mg/L等,这里的Ca、Mg、K、Na是指( )
A. 元素 B. 分子 C. 原子 D. 都不是
【答案】A
【解析】元素是指含有相同的核电荷数的一类原子的总称,一些食品或药品上的营养素一般是指元素,如大多矿泉水瓶的标签上印有如下字样:Ca≥4.0mg/L、Mg≥0.5mg/L、K≥0.35mg/L、Na≥0.8mg/L等,这里的Ca、Mg、K、Na是指元素。

 阅读快车系列答案
阅读快车系列答案【题目】有关物质组成及化学规律的发现对化学的发展做出了重要贡献。
(1)法国化学家拉瓦锡为化学学科的发展做出了巨大贡献,下列有关发现与他有密切关系的是_____。
A. 空气的组成 B. 质量守恒定律 C. 水的组成 D. 酸碱指示剂
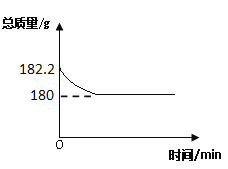
(2)在密闭容器内加入下列两种物质,并称量加入前后的总质量(含密闭容器),能验证质量守恒定律的是_____________(填标号)。
A. 蔗糖和水 B. 氯化钠溶液和硝酸钾溶液 C. 氯化钡溶液和稀硫酸
(3)在氧气中点燃红磷的实验过程,固体质量变化如图所示。
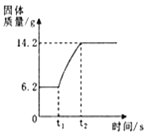
①从燃烧条件分析,固体质量在t1前没有发生变化的原因是___________。
②该反应的化学方程式为________________。
③参加反应的氧气质量为___________g。
(4)某学习小组拟在实验室里利用空气和镁粉为原料制取少量氮化镁(Mg3N2)。
查阅资料可知Mg、Mg3N2能发生如下反应:
①2Mg+O2 △ 2MgO; ②3Mg+N2 △ Mg3N2; ③2Mg+CO2 △ 2MgO+C
④Mg+H2O △ MgO+H2↑ ⑤Mg3N2+6H2O 3Mg(OH)2↓+2NH3↑
实验中所用的装置和药品如图所示(镁粉、还原铁粉均已干燥,装置内所发生的反应是完全的,整套装置的末端与干燥管相连)。回答下列问题:
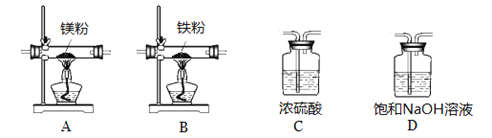
①连接并检查实验装置的气密性,实验开始时,将空气通入实验装置,则气流流经装置的顺序是______(填装置序号)。D装置中发生反应的化学方程式为___________。
②通气后,如果同时点燃A、B装置的酒精灯,对实验结果有何影响?_________。
③设计一个实验,验证产物是否含氮化镁:
实验操作和实验现象 | 实验结论 |
________________________ | 产物中含有氮化镁 |
④思维拓展:空气中N2的含量远大于O2的含量,而镁条在空气中燃烧生成的MgO的质量却远大于Mg3N的质量,请给出合理的解释_______________。