题目内容
【题目】肼(N2H4)是氮和氢形成的一种化合物,易溶于水.工业上利用尿素法生产肼,同时得到出副产品十水合碳酸钠,其工艺流程如下:
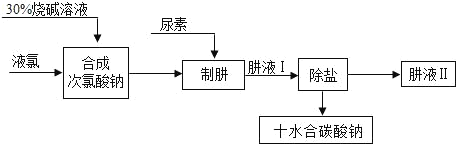
制肼过程的反应为:CO(NH2)2(尿素)+NaClO+2NaOH═N2H4+Na2CO3+NaCl+H2O.
(1)实验室若配制30%烧碱溶液,所需的玻璃仪器除玻璃棒外,还有_____(填编号).
A 漏斗 B 烧杯 C 烧瓶 D 量筒
(2)已知:Cl2+H2O═HCl+HClO,请推测Cl2与NaOH溶液发生反应的化学方程式:_____.从后续反应过程来看,若要使原料不浪费,合成次氯酸钠时投入的液氯与烧碱的质量之比为71:_____.
(3)在实验室中,欲从母液中分离出十水合碳酸钠晶体.可采用的操作依次为_____(填编号).
A 蒸馏 B 蒸发 C 灼烧 D 过滤 E 冷却结晶
(4)肼具有很好的还原性,且氧化产物无污染,故可用于除去锅炉等设备供水中的溶解氧等.请写出肼除氧时发生反应的化学方程式:_____.
【答案】BD Cl2+2NaOH=NaCl+NaClO+H2O 160 BED N2H4+O2=N2+2H2O
【解析】
(1)配制溶液需要在烧杯内进行,需要用量筒量取水,用玻璃棒搅拌,还用到胶头滴管;
(2)由Cl2+H2O=HCl+HClO,可知Cl2与NaOH溶液发生反应时,氯气先与水反应,生成的盐酸、次氯酸再与氢氧化钠反应生成氯化钠、次氯酸钠和水,所以反应物是氯气和氢氧化钠,生成物是氯化钠、次氯酸钠和水,用观察法配平即可,所以方程式是:Cl2+2NaOH=NaCl+NaClO+H2O;根据氯气和氢氧化钠反应的方程式可知:投入的液氯与烧碱的质量之比为:35.5×2:2×40=71:80,再根据方程式:CO(NH2)2(尿素)+NaClO+2NaOH=N2H4+Na2CO3+NaCl+H2O,可知还需要氢氧化钠两份质量,所以液氯与烧碱的质量之比为71:160;
(3)碳酸钠的溶解度随温度变化比较大从溶液中结晶析出的方法:冷却热饱和溶液的方法,所以先将溶液加热蒸发,再降温,使晶体析出,再进行过滤;
(4)肼除氧的反应物是肼和氧气,因为氧化产物无污染所以是氢和氧结合成的水,根据质量守恒定律可知生成物还有氮气,再根据观察法配平,所以化学方程式是:N2H4+O2=N2+2H2O。

【题目】填写化学用语
地壳中含量最多的金属元素 | 两个氯原子 | 三个钠离子 | 画铝原子的结构示意图 |
_____ | _____ | _____ | _____ |
木炭燃烧的文字表达式_____ | 产生刺激性气味气体反应的符号表达式_____ | ||
2Mg2+中前面的“2”表示_____,右上角的“2”表示_____ | |||
若“ | |||
【题目】化学兴趣小组为验证质量守恒定律,做了镁条在空气中燃烧的实验。同学们观察到镁条在空气中剧烈燃烧,发出耀眼的强光,产生的大量白烟弥漫到空气中,最后在石棉网上得到一些白色固体。
(1)请写出镁条燃烧的化学方程式_______________。
(2)同学们通过称量发现:在石棉网上收集到产物的质量小于镁条的质量。有人认为这个反应不遵循质量守恒定律。你认为出现这样实验结果的原因可能是:__________________。
(3)小红按下图装置改进实验,验证了质量守恒定律,还发现产物中有少量黄色固体。

(提出问题)黄色固体是什么?
(查阅资料)①氧化镁为白色固体;②镁能与氮气剧烈反应生成黄色的氮化镁(Mg3N2)固体;③氮化镁可与水剧烈反应产生氨气,该气体能使湿润的红色石蕊试纸变蓝。
(做出猜想)黄色固体是Mg3N2
(实验探究)请设计实验,验证猜想:
实验操作 | 实验现象及结论 |
_________ | _________ |
(反思与交流):空气中N2的含量远大于O2的含量,可是镁条在空气中燃烧产物MgO却远多于Mg3N2,合理的解释是:____________。