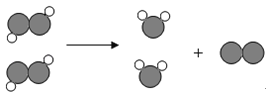
题目内容
【题目】有一种工业废水,其中含有大量的硫酸亚铁、少量硫酸铜和污泥。某同学设计了一个既经济又合理的实验方案,制备硫酸亚铁晶体(FeSO4·7H2O)并回收铜。方案流程如下:
【查阅资料】 FeSO4·7H2O受热易分解。
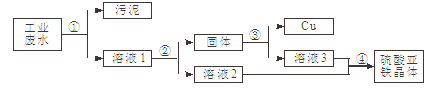
回答下列问题:
(1)步骤①中用到的玻璃仪器有烧杯、漏斗和____________。
(2)步骤②中需加入的物质是___________,目的是_________________________。
(3)步骤③中发生反应的化学方程式是_____________________________。
(4)步骤④的操作是蒸发浓缩、____________、过滤。
【答案】1)玻璃棒 (2)铁(或Fe) 把硫酸铜转化为铜(或把硫酸铜转化为铜和硫酸亚铁,或除去硫酸铜)(3)Fe + H2SO4 = FeSO4 +H2↑ (4)降温结晶(或冷却结晶)
【解析】
试题分析: 根据流程图及所学知识可知,(1)步骤①为过滤,其中用到的玻璃仪器有烧杯、漏斗和玻璃棒;根据③中得到金属铜和④得到硫酸亚铁晶体,(2)步骤②中需加入的物质是铁,目的把硫酸铜转化为铜;(3)步骤③是把过量的铁转化为硫酸亚铁,故发生反应的化学方程式是Fe + H2SO4 = FeSO4 +H2↑;(4)步骤④的操作根据题中资料可知,步骤是蒸发浓缩、降温结晶(或冷却结晶)、过滤

练习册系列答案
相关题目