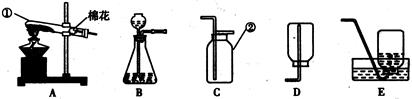题目内容
(11分)请结合下列实验常用装置,回答有关问题。
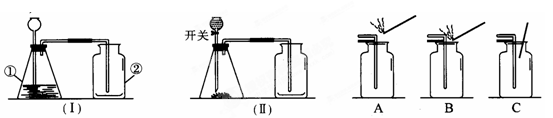
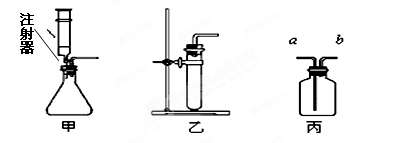
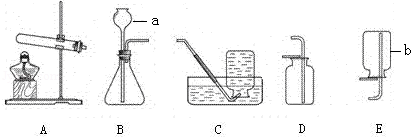
(1)B装置中滴加液体的仪器名称是 。
(2)使用酒精灯时,用火柴或打火机等点燃酒精灯,请写出熄灭酒精灯火焰的方法 。玻璃管插入带孔橡皮塞,先把玻璃管的一段 ,然后稍稍用力转动插入。
(3)如果选用高锰酸钾来制取和收集比较纯净的氧气,应选用的装置是 和 。(填字母代号)用E装置收集气体时,当 时,说明集气瓶已收满气体。
(4)某同学取一根火柴梗,拿住一端迅速平放入酒精灯火焰中,1~2s后取出,观察到位于外焰的部分明显碳化。由上述现象得出结论:外焰温度最高,你认为原因是 。
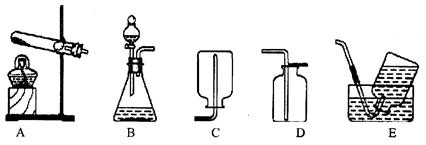
(5)实验室制取二氧化碳,可选用的发生装置为 ,反应的文字表达式是 。
(6)用双氧水和二氧化锰制取氧气;用石灰石和稀盐酸制取二氧化碳气体。其中有关说法不正确的是 。(填写序号)
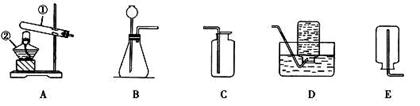
(7)做化学实验要养成良好的整理习惯。若某同学在实验结束后,将仪器按下图放置,其中正确的一项是 。(填序号)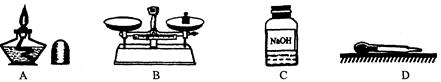

(1)B装置中滴加液体的仪器名称是 。
(2)使用酒精灯时,用火柴或打火机等点燃酒精灯,请写出熄灭酒精灯火焰的方法 。玻璃管插入带孔橡皮塞,先把玻璃管的一段 ,然后稍稍用力转动插入。
(3)如果选用高锰酸钾来制取和收集比较纯净的氧气,应选用的装置是 和 。(填字母代号)用E装置收集气体时,当 时,说明集气瓶已收满气体。
(4)某同学取一根火柴梗,拿住一端迅速平放入酒精灯火焰中,1~2s后取出,观察到位于外焰的部分明显碳化。由上述现象得出结论:外焰温度最高,你认为原因是 。
(5)实验室制取二氧化碳,可选用的发生装置为 ,反应的文字表达式是 。
(6)用双氧水和二氧化锰制取氧气;用石灰石和稀盐酸制取二氧化碳气体。其中有关说法不正确的是 。(填写序号)
| A.都不需要对气体发生装置加热 | B.不是都可以用排水法收集气体 |
| C.都可用向上排空气法收集气体 | D.都可以用相同的发生装置 |

(1)分液漏斗
(2)用灯帽盖灭 用水润湿
(3)A和E 有大气泡从瓶口冒出
(4)与空气中的氧气充分接触
(5)B 碳酸钙+稀盐酸=氯化钙+水+二氧化碳
(6)B
(7)C
(2)用灯帽盖灭 用水润湿
(3)A和E 有大气泡从瓶口冒出
(4)与空气中的氧气充分接触
(5)B 碳酸钙+稀盐酸=氯化钙+水+二氧化碳
(6)B
(7)C
(1)B装置中滴加液体的仪器名称是分液漏斗
(2)使用酒精灯时,用火柴或打火机等点燃酒精灯,请写出熄灭酒精灯火焰的方法用灯帽盖灭火焰.玻璃管插入带孔橡皮塞,先把玻璃管的一段用水润湿,然后稍稍用力转动插入.
(3)根据反应物的状态和反应条件确定发生装置;利用排水法收集的氧气要比向上排空气法收集的氧气纯净
(4)理论上酒精灯火焰的外焰温度最高,原因外焰与空气(或氧气)接触更充分,酒精燃烧更充分;
(5)二氧化碳的反应装置和反应原理:制取二氧化碳使用固体+液体反应,不需加热;
(6)A、由题意可知,实验室制取氧气、二氧化碳的条件都不要加热,故A正确;
B、由于二氧化碳能溶于水,不能用排水法收集,故B错误;
C、由于氧气、二氧化碳的密度大于空气,都能用向上排空气法收集气体,故C正确;
D、由题意可知,实验室制取氧气、二氧化碳的反应物的状态及反应条件相同,发生装置相同,故D正确.
(7)A、不用酒精灯时要用灯帽盖灭,故A错误;
B、托盘天平使用结束后,要把砝码放回砝码盒中,故B错误;
C、不用试剂时,要及时盖好瓶塞,标签向外放好,故C正确;
D、取液后的滴管,应保持橡胶胶帽在上,不能横放或倒置,防止液体倒流,沾污试剂,或腐蚀橡胶胶帽,故D错误.
故选C.
(2)使用酒精灯时,用火柴或打火机等点燃酒精灯,请写出熄灭酒精灯火焰的方法用灯帽盖灭火焰.玻璃管插入带孔橡皮塞,先把玻璃管的一段用水润湿,然后稍稍用力转动插入.
(3)根据反应物的状态和反应条件确定发生装置;利用排水法收集的氧气要比向上排空气法收集的氧气纯净
(4)理论上酒精灯火焰的外焰温度最高,原因外焰与空气(或氧气)接触更充分,酒精燃烧更充分;
(5)二氧化碳的反应装置和反应原理:制取二氧化碳使用固体+液体反应,不需加热;
(6)A、由题意可知,实验室制取氧气、二氧化碳的条件都不要加热,故A正确;
B、由于二氧化碳能溶于水,不能用排水法收集,故B错误;
C、由于氧气、二氧化碳的密度大于空气,都能用向上排空气法收集气体,故C正确;
D、由题意可知,实验室制取氧气、二氧化碳的反应物的状态及反应条件相同,发生装置相同,故D正确.
(7)A、不用酒精灯时要用灯帽盖灭,故A错误;
B、托盘天平使用结束后,要把砝码放回砝码盒中,故B错误;
C、不用试剂时,要及时盖好瓶塞,标签向外放好,故C正确;
D、取液后的滴管,应保持橡胶胶帽在上,不能横放或倒置,防止液体倒流,沾污试剂,或腐蚀橡胶胶帽,故D错误.
故选C.

练习册系列答案
相关题目