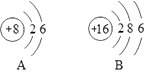
题目内容
【题目】某化工厂的废液中含有硝酸银、硝酸亚铁和硝酸锌.某同学取适量的上述废液样品,将一定质量的镁粉加入样品中,充分反应后过滤,得到滤液和滤渣.请回答下列问题: 
(1)若得到的滤液为浅绿色,则滤液中一定含有哪些溶质?(写化学式)
(2)若得到的滤液为无色,则滤渣中一定含有什么物质?(写化学式)
(3)请写出该实验过程中一定发生的反应的化学方程式.
【答案】
(1)解:将镁粉加入到硝酸银、硝酸亚铁和硝酸锌的混合物中,则镁首先与硝酸银反应,得到的滤液为浅绿色,则滤液中含有硝酸亚铁,硝酸锌一定没有参与反应,硝酸银不一定含有
答:Zn(NO3)2、Mg(NO3)2、Fe(NO3)2
(2)解:得到的滤液为无色,则硝酸亚铁全部反应,得到的滤渣一定含有银和铁,故为:Ag、Fe;
(3)解:该实验中镁一定与硝酸银反应生成硝酸镁和银,故为:Mg+2AgNO3═Mg(NO3)2+2Ag
【解析】根据金属的性质进行分析解答,在金属活动性顺序中,氢前的金属能与酸反应生成氢气,位置在前的金属能将位于其后的金属从其盐溶液中置换处理,据此解答.
【考点精析】本题主要考查了金属材料的选择依据和书写化学方程式、文字表达式、电离方程式的相关知识点,需要掌握黑色金属:通常指铁、锰、铬及它们的合金.重金属:如铜、锌、铅等;有色金属轻金属:如钠、镁、铝等;有色金属:通常是指除黑色金属以外的其他金属;注意:a、配平 b、条件 c、箭号才能正确解答此题.

【题目】若将一定量的某种电池燃料R和氧气置于一个完全封闭的容器中,在一定的条件下充分反应,测得前后各物质的质量如表:
物质 | R | 氧气 | 水 | 二氧化碳 |
反应前质量/g | 8.0 | 9.6 | 0 | 0 |
反应后质量/g | 待测 | 0 | 7.2 | 8.8 |
下列说法中正确的是 .
A.表中待测的值为1.6
B.R物质只含有碳、氢元素
C.R物质中碳、氢质量比为1:3
D.反应生成二氧化碳和水的分子个数比为 .
【题目】实验室常制取某些气体,请你根据所学知识回答下列问题: 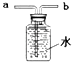
(1)实验室制取氧气时,若用如图装置收集氧气,则气体应从(填“a”或“b”).
(2)小明取一定浓度的盐酸与石灰石反应制取气体,反应的化学方程式为;将生成的气体通入澄清石灰水中,未见变浑浊.为探究其原因,进行了如下过程:
(3)【作出猜想】A.石灰水已经完全变质; B.气体中有挥发出来的HCl气体. 【实验探究】
①取少量石灰水于试管中,并向试管中滴加几滴无色酚酞试液,振荡,观察到溶液变红色.于是排除了猜想A,你认为排除猜想A的理由是 .
②小明想探究所得气体中是否有挥发出来的HCl气体,设计如下实验.请你帮他完成实验,填写以下表格:
实验步骤 | 实验现象 | 实验结论 |
气体中有HCl |
(4)【实验思考】要除去所制得的二氧化碳气体中的HCl气体,一般选用溶液.
(5)【拓展延伸】假如用100克14.6%的稀盐酸和足量的石灰石反应,反应停止后,问可以收集的气体的质量为多少?