题目内容
【题目】如图是利用石灰石,食盐水,氨气进行工业生产纯碱的流程示意图(部分条件及物质未标出). 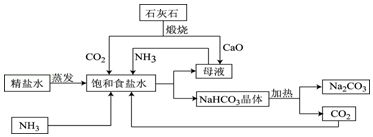
(1)粗盐精炼成精盐的过程中,要经过溶解、、蒸发等操作,其中都必需用到的一种玻璃仪器为 ,
(2)图中母液含有一定量的NaHCO3 , 该溶液为该温度下NaHCO3的(填“饱和”或“不饱和”)溶液;
(3)流程中要通入CO2和NH3 , 应先通入NH3 , 理由是;精盐水经过氨化和二氧化碳酸化后生成碳酸氢钠和一种氮肥,请写出相应的化学方程式: .
(4)整个生产过程中可循环利用的物质为(填化学式).
(5)所得产品纯碱中含有少量碳酸氢钠,如果用加热分解的方法测定纯碱中碳酸氢钠的质量分数,纯碱中碳酸氢钠的质量分数可表示为(加热前固体的质量为m1 , 加热后为m2 ): .
【答案】
(1)过滤;玻璃棒
(2)饱和
(3)通入氨气后溶液显碱性,更容易吸收二氧化碳;NaCl+H2O+CO2+NH3═NaHCO3↓+NH4Cl
(4)CO2、NH3
(5)![]() %
%
【解析】解:(1)粗盐精炼成精盐的过程中,要经过溶解、过滤、蒸发等操作,其中都必需用到的一种玻璃仪器是玻璃棒,在溶解过程中玻璃棒用来搅拌,过滤时滤液玻璃棒引流,蒸发水利用玻璃棒搅拌,防止液体飞溅. 故填:过滤;玻璃棒.(2)图中母液含有一定量的NaHCO3 , 该溶液为该温度下NaHCO3的饱和溶液.
故填:饱和.(3)流程中要通入CO2和NH3 , 应先通入NH3 , 理由是通入氨气后溶液显碱性,更容易吸收二氧化碳;
精盐水经过氨化和二氧化碳酸化后生成碳酸氢钠和氯化铵,反应的化学方程式为:NaCl+H2O+CO2+NH3═NaHCO3↓+NH4Cl.
故填:通入氨气后溶液显碱性,更容易吸收二氧化碳;NaCl+H2O+CO2+NH3═NaHCO3↓+NH4Cl.(4)整个生产过程中可循环利用的物质为CO2、NH3 .
故填:CO2、NH3 . (5)设碳酸氢钠质量为x,
2NaHCO3 | Na2CO3+H2O+CO2↑, | 反应前后固体质量差 |
168 | 106 | 168﹣106=62 |
x | m1﹣m2 |
![]() =
= ![]() ,
,
x= ![]() ( m1﹣m2 ),
( m1﹣m2 ),
纯碱中碳酸氢钠的质量分数为: ![]() ( m1﹣m2 )×100%=
( m1﹣m2 )×100%= ![]() %,
%,
故填: ![]() %.
%.
【考点精析】根据题目的已知条件,利用饱和溶液和不饱和溶液和书写化学方程式、文字表达式、电离方程式的相关知识可以得到问题的答案,需要掌握饱和与不饱和的判断方法:看有无不溶物或继续加入该溶质,看能否溶解;注意:a、配平 b、条件 c、箭号.