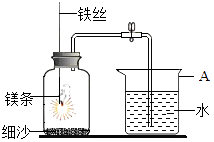
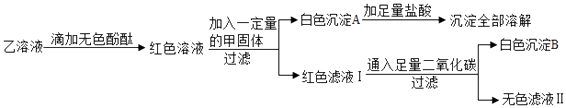
题目内容
【题目】如图是a、b、c三种物质的溶解度曲线,根据曲线回答下列问题: 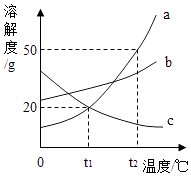
(1)t1℃时a、b、c三种物质溶解度的大小顺序是 .
(2)b物质接近饱和的溶液转化为饱和溶液的方法有 .
(3)若用10%的a溶液100g稀释成5%溶液,需要加水的质量为 .
(4)下列说法正确的是
A.将t2℃时c的饱和溶液降温,c的溶质质量分数变大;
B.等质量的a、b的t2℃饱和溶液降温到t1℃时,a溶液中的溶剂比b中少些;
C.c晶体中含有少量a时可以采取加适量热水溶解后,趁热过滤的方法提纯c
D.b的溶液降温后一定有b析出
E.用固体a可以配制20%的t1℃的溶液.
【答案】
(1)b>a=c
(2)降低温度、蒸发溶剂、增加溶质
(3)100g
(4)BC
【解析】解:(1)通过分析溶解度曲线可知,t1℃时,a、b、c三种物质溶解度的大小顺序是b>a=c;(2)b物质的溶解度随温度的升高而增大,所以b物质接近饱和的溶液转化为饱和溶液的方法有降低温度、蒸发溶剂、增加溶质;(3)若用10%的a溶液100g稀释成5%溶液,需要加水的质量为: ![]() ﹣100g=100g;(4)A、c物质的溶解度随温度的降低而增大,所以将t2℃时c的饱和溶液降温,c的溶质质量分数不变,故A错误;B、t2℃时,b物质的溶解度大于A物质的溶解度,所以等质量的a、b的t2℃饱和溶液降温到t1℃时,a溶液中的溶剂比b中少些,故B正确;
﹣100g=100g;(4)A、c物质的溶解度随温度的降低而增大,所以将t2℃时c的饱和溶液降温,c的溶质质量分数不变,故A错误;B、t2℃时,b物质的溶解度大于A物质的溶解度,所以等质量的a、b的t2℃饱和溶液降温到t1℃时,a溶液中的溶剂比b中少些,故B正确;
C、c晶体中含有少量a时可以采取加适量热水溶解后,趁热过滤的方法提纯c,故C正确;
D、b的饱和溶液降温后一定有b析出,故D错误;
E、t1℃时,a物质饱和溶液的质量分数为: ![]() ×100%=16.7%,所以用固体a不可以配制20%的t1℃的溶液,故E错误.
×100%=16.7%,所以用固体a不可以配制20%的t1℃的溶液,故E错误.
故选:BC.
给答案为:(1)b>a=c;(2)降低温度、蒸发溶剂、增加溶质;(3)100g;(4)BC.
【考点精析】利用结晶的原理、方法及其应用和饱和溶液和不饱和溶液相互转变的方法对题目进行判断即可得到答案,需要熟知结晶的两种方法:蒸发溶剂,如NaCl(海水晒盐)和降低温度(冷却热的饱和溶液,如KNO3);饱和和不饱和的转变方法:①Ca(OH)2和气体等除外,它的溶解度随温度升高而降低②最可靠的方法是:加溶质、蒸发溶剂.