题目内容
【题目】某化学兴趣小组用如图装置验证一氧化碳还原氧化铜,并探究其还原产物的组成.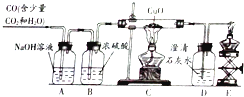
(1)装置及反应原理探究
①B装置中浓硫酸的作用为 .
②说明CO能还原CuO的现象为.
③上述整套装置中发生的化学反应,其中属于化合反应的化学方程式 . (不考虑CO2和H2O的反应.)
(2)产物成分探究
[查阅资料]Ⅰ、一氧化碳还原氧化铜.除生成铜外还可能生成氧化亚铜(Cu2O)
Ⅱ、Cu2O为不溶于水的红色固体
Ⅲ、Cu2O+H2SO4═CuSO4+Cu+H2O
[提出问题]红色固体含有什么物质?
[猜想假设]假设一:红色固体只含Cu
假设二:红色固体只含Cu2O
假设三:
[实验验证]该小组为验证上述假设,取少量红色固体,加到足量稀硫酸中,观察到溶液变为蓝色,红色固体部分溶解.
[实验结论]根据上述实验结果,可知红色固体中一定含有 .
[数据处理]为进一步确定红色固体的成分,甲、乙两同不分别称取各自实验后的一定质量的红色固体,加到足量稀硫酸中使其充分反应,经过滤、洗涤、干燥后,称量剩余红色固体质量如表,请完善表中内容.
实验人员 | 红色固体(g) | 剩余红色固体(g) | 实验结论 |
甲 | 7.2 | 3.2 | |
乙 | 4.08 | 2.48 |
[交流与反思]只要假设合理,方法正确,根据实验现象和数据就能得出结论.
【答案】
(1)干燥一氧化碳;C装置中黑色粉末变成红色,D装置中澄清石灰水变浑浊;2CO+O2![]() 2CO2
2CO2
(2)红色固体含有Cu2O和Cu;Cu2O和Cu;假设二成立;假设三成立
【解析】(1)①浓硫酸有吸水性,所以B装置中浓硫酸的作用为:干燥一氧化碳;②一氧化碳和氧化铜在加热的条件下生成铜和二氧化碳,二氧化碳和氢氧化钙反应生成碳酸钙沉淀和水,所以说明CO能还原CuO的现象为:C装置中黑色粉末变成红色,D装置中澄清石灰水变浑浊;③一氧化碳和氧气在点燃的条件下生成二氧化碳,化学方程式为:2CO+O2![]() 2CO2;(2)【猜想假设】一氧化碳还原氧化铜.除生成铜外还可能生成氧化亚铜(Cu2O),可能只有一种物质,也可能是假设三:红色固体含有Cu2O和Cu;
2CO2;(2)【猜想假设】一氧化碳还原氧化铜.除生成铜外还可能生成氧化亚铜(Cu2O),可能只有一种物质,也可能是假设三:红色固体含有Cu2O和Cu;
【实验结论】取少量红色固体,加到足量稀硫酸中,观察到溶液变为蓝色,红色固体部分溶解,所以红色固体中一定含有Cu2O和Cu;
【数据处理】
设参加反应的氧化亚铜质量为x
Cu2O+H2SO4═CuSO4+Cu+H2O 固体减少
144 80
x 4g![]() =
= ![]()
x=7.2g,
所以红色固体全部是氧化亚铜,假设二成立;
设参加反应的氧化亚铜质量为y
Cu2O+H2SO4═CuSO4+Cu+H2O 固体减少
144 80
y 1.6g![]() =
= ![]()
y=2.88g
所以红色固体中含有氧化亚铜质量是2.88g、铜的质量是2g,假设三成立.
所以答案是:(1)①干燥一氧化碳;②C装置中黑色粉末变成红色,D装置中澄清石灰水变浑浊;③2CO+O2![]() 2CO2;(2)【猜想假设】红色固体含有Cu2O和Cu;
2CO2;(2)【猜想假设】红色固体含有Cu2O和Cu;
【实验结论】Cu2O和Cu;
【数据处理】假设二成立;假设三成立.
【考点精析】通过灵活运用一氧化碳的性质和书写化学方程式、文字表达式、电离方程式,掌握一氧化碳的物理性质:无色,无味的气体,密度比空气略小,难溶于水;一氧化碳的化学性质:可燃性和还原性;注意:a、配平 b、条件 c、箭号即可以解答此题.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案