题目内容
【题目】有A~F六种物质,已知A、B、C三种固体含有同种金属元素,A是大理石、石灰石的主要成分,B是一种氧化物能与E反应放出大量的热,D、E、F含有同种非金属元素,E通常状况下为液体,D、F通常状况下为气体,且F为单质。它们的转化关系如图(部分产物已略去)。温馨提示:图中“→”表示箭尾的物质可转化成箭头的物质;“﹣”表示两端的物质能发生化学反应。
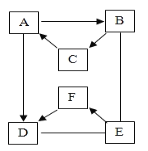
(1)写出A、E物质的名称:A_____,E_____。
(2)写出C→A的化学方程式:_____。
(3)写出E→F的化学方程式:_____。
【答案】碳酸钙 水 Ca(OH)2+CO2═CaCO3↓+H2O 2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
【解析】
根据题干提供的信息进行分析解答,A、B、C三种固体含有同种金属元素,A是大理石、石灰石的主要成分,故A是碳酸钙;B是一种氧化物能与E反应放出大量的热,E通常状况下为液体,故B是氧化钙,E是水;C是氢氧化钙;碳酸钙能反应生成D,D为气体,故D是二氧化碳,F为单质,能由水生成,且能生成二氧化碳,故F是氧气,据此解答。
A、B、C三种固体含有同种金属元素,A是大理石、石灰石的主要成分,故A是碳酸钙;B是一种氧化物能与E反应放出大量的热,E通常状况下为液体,故B是氧化钙,E是水;C是氢氧化钙;碳酸钙能反应生成D,D为气体,故D是二氧化碳,F为单质,能由水生成,且能生成二氧化碳,故F是氧气,带入框图,推断合理;
(1)A是碳酸钙,E是水;故填:碳酸钙,水
(2)C是氢氧化钙,A是碳酸钙,氢氧化钙能与二氧化碳反应生成碳酸钙沉淀和水,方程式为:Ca(OH)2+CO2═CaCO3↓+H2O;故填:Ca(OH)2+CO2═CaCO3↓+H2O
(3)水通电分解生成氢气和氧气,故E→F的化学方程式为:2H2O![]() 2H2↑+O2↑。故填:2H2O
2H2↑+O2↑。故填:2H2O![]() 2H2↑+O2↑
2H2↑+O2↑