��Ŀ����
����Ŀ����һ��������̼��ط�ĩ���������ʿ���������ء�����ơ��Ȼ��ء��Ȼ�������̼�����е�һ�ֻ��֡�Ϊȷ����ɷ֣���������ʵ�飺
��1��ȡ�����÷�ĩ���Թ��У���������ˮ����ܽ⣬�õ���ɫ������Һ�������Һ�м�����������������Һ���а�ɫ�����������ټ���������ϡ���ᣬ��ַ�Ӧ���ְ�ɫ������ʧ��
��2����ȡ13.8 g�÷�ĩ���ձ��У���ˮʹ����ȫ�ܽ⣬�ټ���200 gһ�����������������Ȼ�����Һ��ǡ����ȫ��Ӧ������19.7 g��ɫ������
����˵����ȷ���ǣ�������
A. ������һ���������Ȼ�����
B. �����п��ܺ�������ء�̼����
C. �ð���ĩ�����ֻ���������
D. �����Ȼ�����Һ��������������Ϊ20.8%
���𰸡�A
��������
�Ȼ���������Һ����dz��ɫ��̼���ƺ�����Ʒ�Ӧ������̼��Ƴ�����̼������Ӻ������ӷ�Ӧ�����������̼���������������Ӻ������ӷ�Ӧ���ɲ���������Ȼ���������̼������Ӻͱ����ӷ�Ӧ����̼�ᱵ���������ԣ�ȡ�����÷�ĩ���Թ��У���������ˮ����ܽ⣬�õ���ɫ������Һ��˵���˻������һ���������Ȼ�����������ƣ������Һ�м�����������������Һ���а�ɫ�����������ټ���������ϡ���ᣬ��ַ�Ӧ���ְ�ɫ������ʧ��˵���˻�����к����Ȼ��ء�
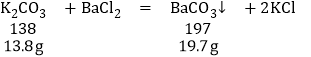
�ɻ�ѧ����ʽ��֪������13.8gȫ����̼��أ�����̼�ᱵ������19.7g
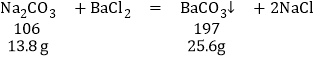
�ɻ�ѧ����ʽ��֪������13.8gȫ����̼���ƣ�����̼�ᱵ����������19.7g���������ʺ�Ҳ��������19.7g��̼�ᱵ���������ں��������Ȼ��أ����ԣ�һ������̼���ơ�
A��������������֪��������һ���������Ȼ���������A��ȷ��
B��������һ�������Ȼ��ء�̼���ƿ��ܺ�������أ���B����
C���ð���ĩ�������̼��ء��Ȼ��غ�̼���ƣ�̼��ء��Ȼ��ء�̼���ƺ�����������������C����
D���������Ȼ�����Һ�����ʵ���������Ϊx
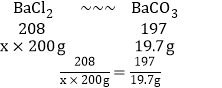
x��10.4%
�����Ȼ�����Һ�����ʵ���������Ϊ10.4%����D����
��ѡ��A��

 �¿α�������������ҵ�������γ�����ϵ�д�
�¿α�������������ҵ�������γ�����ϵ�д� ����ν����Ž̲��㽭���̴�ѧ������ϵ�д�
����ν����Ž̲��㽭���̴�ѧ������ϵ�д� �����Ļ������������������ϵ�д�
�����Ļ������������������ϵ�д�