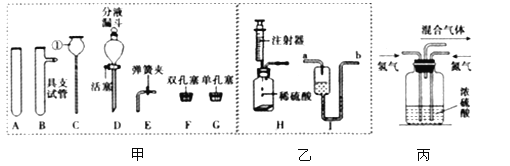
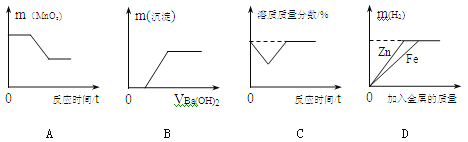
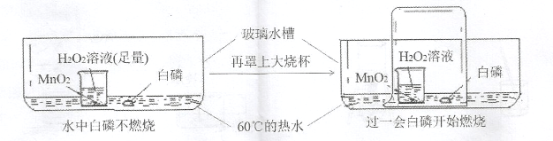
题目内容
【题目】已知,有元素化合价升降的反应属于氧化还原反应。下列反应中,属于氧化还原反应的是

A.①③ B.②⑤ C.①④ D.④⑤
【答案】C
【解析】
试题分析:A、①铜和氧气在加热条件下,生成氧化铜,铜元素化合价由0变为+2,属于氧化还原反应,氯化铜和氢氧化钠反应,生成氢氧化铜氯化钠,属于复分解反应,元素化合价无变化,不属于氧化还原反应,错误;B、②氧化铜和盐酸反应,生成氯化铜和水,属于复分解反应,元素化合价无变化,错误;⑤B为氢氧化铜,氢氧化铜在加热条件下生成氧化铜和水,元素化合价无变化,错误;C、①铜和氧气在加热条件下,生成氧化铜,铜元素化合价由0变为+2,属于氧化还原反应;④铁和氯化铜反应,生成铜和氯化亚铁,属于置换反应,一定有元素化合价发生变化,属于氧化还原反应;D、④铁和氯化铜反应,生成铜和氯化亚铁,属于置换反应,一定有元素化合价发生变化,属于氧化还原反应;⑤⑤B为氢氧化铜,氢氧化铜在加热条件下生成氧化铜和水,元素化合价无变化,不属于氧化还原反应。故选C

 金钥匙试卷系列答案
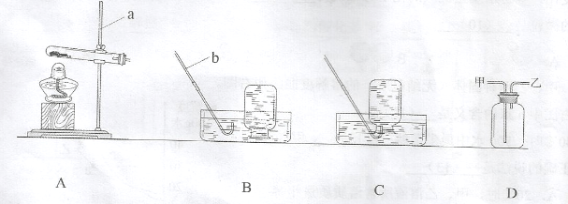
金钥匙试卷系列答案【题目】(6分)硝酸铜为蓝色固体,溶于水可得蓝色溶液。某实验小组同学用下图装置加热硝酸铜,发现固体由蓝色逐渐变黑,同时产生红棕色有刺激性气味的气体,带火星的木条复燃。
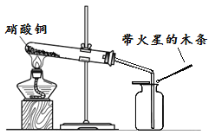
【提出问题】硝酸铜在加热条件下到底发生了怎样的反应?
【查阅资料】
①氧化铜和稀硫酸反应的化学方程式:CuO+H2SO4![]() CuSO4+H2O
CuSO4+H2O
②含氮化合物中,只有NO2是红棕色、有刺激性气味的气体。
③NO2有助燃性,能使带火星的木条复燃
【猜想假设】
Cu(NO3)2受热分解除了生成_______,还可能生成了CuO和O2。
【进行实验】
实验操作 | 实验现象 | 实验结论 |
步骤I:将反应后试管中的固体加水充分溶解, ① ,加热 | 固体全部溶解,得到蓝色溶液 | 硝酸铜分解生成了氧化铜。 |
步骤II:在图1的试管和集气瓶之间连上如图所示的装置,重新进行加热硝酸铜的实验
| 集气瓶中气体为无色,带火星木条复燃 | 硝酸铜分解生成了氧气 |
步骤II是同学们查阅了新的资料后设计完成的。该资料是关于NO2___②__方面的性质信息。
【获得结论】根据实验结果,Cu(NO3)2受热分解的化学方程式为_______。
【反思与评价】已知相同状况下,气体的体积比等于其分子个数比。据此,同学们认为,即使没有资料③,依据实验结论和“加热硝酸铜产生的气体能使带火星的木条复燃”的实验现象,也能推出NO2可能具有助燃性。理由是______。