题目内容
(2010?乐陵市一模)长期使用热水瓶底部或热水器中有水垢,主要成分是碳酸钙和氢氧化镁(假设无其它杂质).某课外小组想测定水垢中碳酸钙的含量,他们取20.8g水垢,加入足量的浓度为14.6%的盐酸,其中产生的二氧化碳的数据见下表.| 时间/min | 1 | 2 | 3 | 4 | 5 |
| 生成二氧化碳的质量/g | 3.0 | 5.0 | 6.0 | 6.6 | 6.6 |
(2)要使20.8g水垢完全溶解,最少需要盐酸的质量.
【答案】分析:(1)由图可知,4s后恰好完全反应,放出二氧化碳6.6g;根据反应的化学方程式,由生成二氧化碳的质量计算水垢中碳酸钙的质量;
(2)计算碳酸钙和氢氧化镁完全反应所消耗HCl的质量,由所计算HCl质量与溶液的质量分数,利用溶质质量分数公式,计算所需稀盐酸的质量.
解答:解:(1)由题意知加入足量盐酸后完全反应生成二氧化碳的质量为6.6g
设碳酸钙的质量为x 与其反应的盐酸质量为y
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 73 44
x 14.6%y 6.6g
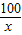 =
=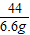 x=15g
x=15g
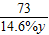 =
=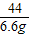 y=75g
y=75g
答:碳酸钙的质量为15g
(2)水垢中氢氧化镁的质量为:20.8g-15g=5.8g
设和5.8g Mg(OH)2反应的盐酸质量为a,
Mg(OH)2+2HCl=MgCl2+2H2O
58 73
5.8g 14.6%a
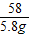 =
=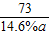
a=50g
盐酸总质量为:75g+50g=125g
答:需要盐酸质量为125g
点评:分析变化表格时,根据最后氢气的质量不再变化可知混合物已经完全反应,此时放出气体的质量为最大质量,然后根据气体的量求解.
(2)计算碳酸钙和氢氧化镁完全反应所消耗HCl的质量,由所计算HCl质量与溶液的质量分数,利用溶质质量分数公式,计算所需稀盐酸的质量.
解答:解:(1)由题意知加入足量盐酸后完全反应生成二氧化碳的质量为6.6g
设碳酸钙的质量为x 与其反应的盐酸质量为y
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 73 44
x 14.6%y 6.6g
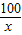 =
=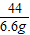 x=15g
x=15g 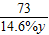 =
=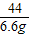 y=75g
y=75g答:碳酸钙的质量为15g
(2)水垢中氢氧化镁的质量为:20.8g-15g=5.8g
设和5.8g Mg(OH)2反应的盐酸质量为a,
Mg(OH)2+2HCl=MgCl2+2H2O
58 73
5.8g 14.6%a
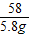 =
=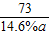
a=50g
盐酸总质量为:75g+50g=125g
答:需要盐酸质量为125g
点评:分析变化表格时,根据最后氢气的质量不再变化可知混合物已经完全反应,此时放出气体的质量为最大质量,然后根据气体的量求解.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
(2010?乐陵市一模)影响化学反应速率的因素有多种.请选择其中的一个因素,按表中示例设计实验证明,并完成填空.
你认为能改变化学反应速率因素可能还有______等.
| 影响因素 | 操作步骤 | 现象与结论 |
| 示例:浓度 | 在相同条件下,取两份相同质量的H2O2溶液,其中一份浓度为5%,另一份浓度为15% | 15%的H2O2 溶液分解速率明显比5%的H2O2 溶液的分解速率快,说明浓度能改变化学反应速率. |
(2010?乐陵市一模)食物不仅能为人类生命活动提供能量,且食品中的某些成分还具有保健功能,但腐败的食物对人体健康有害.存放时间过长的淀粉容易发生霉变,滋生黄曲霉菌,蛋白质、油脂等物质存放时间过长因缓慢氧化会变质.下表是某食品包装袋上的部分说明:
请根据以上信息,回答下列有关问题:
(1)该苏打饼干的配料中富含维生素的是;
(2)这种饼干具有缓解人们常说的胃酸症状,其原因是.
(3)2006年6月15日食用这包饼干是否可能对人体健康有害?(填“可能”或“不可能”),其理由是.
| 品名 | 苏打饼 |
| 配料 | 小麦粉、鲜鸡蛋、精练食用植物油、白砂糖、奶油、食盐、碳酸氢钠、橙汁 |
| 保质期 | 十二个月 |
| 生产日期 | 2004年4月30日 |
(1)该苏打饼干的配料中富含维生素的是;
(2)这种饼干具有缓解人们常说的胃酸症状,其原因是.
(3)2006年6月15日食用这包饼干是否可能对人体健康有害?(填“可能”或“不可能”),其理由是.
