题目内容
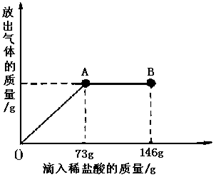
(9分)已知 Na2CO3的水溶液呈碱性,在一烧杯中盛有21.4g Na2CO3和NaCl组成的固体混合物。向其中逐渐滴加溶质质量分数为10%的稀盐酸。放出气体的总质量与所滴入稀盐酸的质量关系曲线如图所示,请根据题意回答问题:
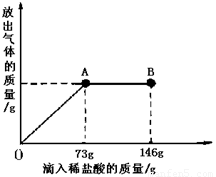
(1)当滴加稀盐酸至图中A点时,放出气体的质量是 g
(2)当滴加稀盐酸至图中B点时,烧杯中溶液的溶质是 。
(3)当滴加稀盐酸至图中A点时,烧杯中为不饱和溶液(常温),通过计算求出其中溶质的质量分数。
【答案】
(1)4.4 (2)NaCl HCl (3)25%
【解析】①根据放出气体的总质量与所滴入稀盐酸的质量关系曲线图,当滴加了73g稀盐酸时恰好完全反应,生成二氧化碳4.4g,故答案为:4.4;
②因由图可知在A点时恰好完全反应,再继续加盐酸不发生反应,则在B点时盐酸过量,溶液中的溶质为HCl、NaCl,故答案为:HCl、NaCl;
(3)解:设样品中碳酸钠质量为x,生成氯化钠质量为y,生成二氧化碳质量为z
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 73 117 44
x 73g×10% y z
x/106=73g×10%/73=y/117=z/44
x=10.6g y=11.7g z=4.4g
反应后溶液中:溶质NaCl:(21.4-10.6)g+11.7g=22.5g
溶液的质量:21.4g+73g-4.4g=90g
反应后的溶液的溶质质量分数=22.5g/90g×100%=25%

练习册系列答案
相关题目