题目内容
【题目】甲同学家新换了水龙头,是铜质镀铬的。她为比较铬与常见金属铁、铜的活动性强弱,进行了如下实验。(已知,铬能与稀硫酸发生置换反应,生成蓝色的硫酸亚铬(CrSO4)溶液。)

(1)请写出实验一观察到的现象是______
(2)请写出实验二中铁与硫酸铜溶液反应的化学方程式: ______
(3)实验三无变化,据此判断铬与铁、铜的金属活动性强弱顺序是______
【答案】铬片上有气泡生成,溶液由无色逐渐变为蓝色 Fe + CuSO4 =FeSO4 + Cu Cr>Fe>Cu
【解析】
(1)由题意可知,铬与稀硫酸反应生成了硫酸亚铬和氢气,反应的现象是:铬片上有气泡生成,溶液由无色逐渐变为蓝色;
(2)铁与硫酸铜溶液反应生成了硫酸亚铁和铜,反应的化学方程式是:Fe+CuSO4=FeSO4+Cu;
(3)由题意可知,铬能与稀硫酸反应说明了铬排在氢的前边,活动性大于铜,又由于铁不能与硫酸亚铬反应,说明了铬的活动性大于铁,所以铬与铁、铜的金属活动性强弱顺序是 Cr>Fe>Cu。
故答为:(1)铬片上有气泡生成,溶液由无色逐渐变为蓝色;
(2)Fe+CuSO4=FeSO4+Cu;
(3)Cr>Fe>Cu。

 名校课堂系列答案
名校课堂系列答案【题目】小兵和小东是某校化学研究性学习小组的成员,他们在查阅资料时,发现单质碳能够在高温时与金属氧化物反应得到金属单质。于是,他们用木炭与CuO进行了如下的探究活动.请你参与他们的这次活动,并解决的关问题:
【提出问题】
木碳与氧化铜反应除生成单质铜外,另一种生成物是什么?
【猜想与假设】
(1)可能是CO.(2)可能是CO2.
【设计实验方案】
(1)检验CO2的方法是(用化学方程式表示)_________________________________________。
(2)为了检验CO,他们设计的方案是:把小动物放在收集的气体中,观察能否存活.后经充分研究后,认为此方案不可行,其不可行的理由是_____________________________。
他们在互联网上用Google收集到这样一条信息:把滤纸浸泡在磷钼酸和氯化钯的黄色混合溶液中制成的试纸遇CO立即变成蓝色,而遇CO2不变色.
【实验与结论】设计的实验装置图如下:
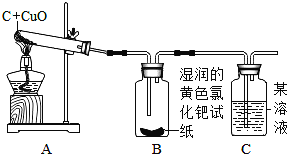
实验现象 | 实验结论 |
A中固体由黑色变成红色 | 有________生成 |
B中黄色试纸没有变蓝 | 没有________生成 |
C中_______________ | 有CO2生成 |
【反思与评价】
如果A装置中的试管口高于试管底部,在实验过程中可能造成的后果是___________________。