题目内容
【题目】氨气是一种无色有刺激性气味的气体,极易溶于水,它的水溶液称为氨水,显碱性。氨气在化学工业中用途很广泛,例如制化肥等。近年来,氨气还用于环境治理。
(1)“候氏制碱法”的两步主要反应原理可表示为:
①NH3+CO2 +H2O+NaCl=NaHCO3↓+NH4Cl,
②2NaHCO3![]() Na2CO3 + H2O + CO2↑。
Na2CO3 + H2O + CO2↑。
其中,NaHCO3属于 (“酸”、“碱”或“盐”)。反应②属于 (填一种基本反应类型)反应,该反应 (选填“吸收”或“放出”)热量。
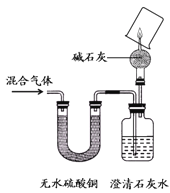
(2)在细菌作用下,用氨处理含甲醇的工业废水,使其变为无毒的N2和CO2,从而清除对环境的污染,有关的反应为:6NH3 + 5CH3OH + 12B = 3N2↑+ 5CO2↑+ 19H2O,其中B物质的化学式是 。
(3)有些工厂排放的废水中含有硫酸,如果用氨水(NH3·H2O)中和它,能得到一种铵态氮肥,该反应的化学方程式为: 。
【答案】(1)盐 分解反应 吸收(2)O2(3)2 NH3·H2O+ H2 SO4=(NH4)2SO4 +2 H2O
【解析】
试题分析:(1)由金属离子钠离子和酸根离子碳酸氢根离子构成,为盐; 一种物质生成三种,属于分解反应;条件为加热,说明需要吸收热量;
(2)6NH3 + 5CH3OH + 12B = 3N2↑+ 5CO2↑+ 19H2O反应前:6N 反应后:6N 38H 38H 5C 5C 5O 29O反应后有29个0原子,而反应前有5个O原子.根据化学反应前后质量守恒推得B中有29-5=24个氧原子.又因为氧气的化学式为O2.所以推得B的系数为:24除以2等于12.所以B的化学式为O2(3)即为硫酸和氨水发生的中和反应,生成硫酸铵和水。

 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案【题目】通过晾晒海水或煮井盐水、盐湖水等,可以蒸发除去水分,得到粗盐,粗盐中含有多种可溶性杂质(氯化镁、氯化钙等)和不溶性杂质(泥沙等).通过如图所示过程,使粗盐得到初步提纯:
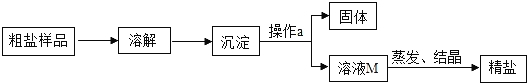
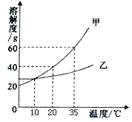
(1)操作a的名称是 ,该操作中要用到的玻璃仪器有烧杯、玻璃棒、 .
(2)通过蒸发M溶液中的水分使之浓缩结晶,想一想,能否采用降低溶液温度的方法来达到同一目的? (填“能”或“否”).理由是 .
(3)在蒸发操作时,当蒸发皿中出现较多量固体时,应 ,利用蒸发皿的余热使滤液蒸干.
(4)某同学欲通过实验探究所得精盐是否是纯净物,进行了如下实验.
实验步骤 | 实验现象 | 实验结论 |
取一定量精盐样品于试管中,加水使之完全溶解,并向其中加入①____________ | ②_____________ | 写出一个相应的化学方程式:③ ________________ 结论:该精盐样品为混合物 |