��Ŀ����
����Ŀ�������������������о��й㷺��Ӧ�á�
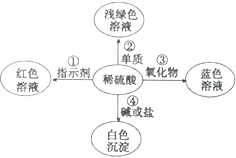
��1�����н�����Ʒ�У����ý��������Ե���_____������ţ���

��2������Ʒ��ʴ�Ĺ��̣�ʵ��������������е�H2O��O2������Ӧ�Ĺ��̡����з�ֹ������������ķ�����_____�����Ļ�ѧ���ʱ������ã���ͨ������Ʒ������Ʒ����ʴ��ԭ����_____��
��3��̽��Fe��Cu��Ag���ֽ������˳���ʵ�鷽���кܶ࣬��д��̽�������ֽ������˳����漰����һ����ѧ����ʽ_____��
��4����Cu(NO3)2��Al(NO3)3��AgNO3�Ļ��Һ�м���һ������п�ۺ����ۣ���ַ�Ӧ����ˡ�ϴ�ӣ��õ���������Һ������˵����ȷ������________��
A�������м���ϡ���ᣬ�����ݲ�������������һ����п����
B��Ӧ����Һ��������ԭ�����Һ������С
C����ҺΪ��ɫʱ��������һ��������һ������п����
D�������м���ϡ���ᣬ�����ݲ���������Һ��һ������������
���𰸡�C ���������������ͽྻ ���������������Ӧ����һ�����ܵ������ﱡĤ����ֹ�ڲ�����һ�������� Fe+CuSO4=Cu+FeSO4 C
��������
(1)A���ƽ���Ʒ����������Ϊ�ƽ�Ľ������ʲ��������⣻
B��ͭ�����ܵ�������Ϊͭ�ĵ����ԣ��ʲ��������⣻
C�����������������ĵ����ԣ��ʷ������⣬����д��C��
(2)������ʵ������������е�������ˮ��Ӧ�Ľ�������������ĺ����������ɴﵽĿ�ģ��磺�����������������Ϳ��һ��ʳ���͵ȣ��ʴ�Ϊ�������������������Ϳ��һ��ʳ���ͣ�����д�����������������ͽྻ���𰸲�Ψһ���������ɣ���
ͨ�����������Ʒ����ʴ��������Ϊ���ڳ�����������е�����������ѧ��Ӧ��ʹ���ı���������һ�����ܵ���������Ĥ�Ӷ���ֹ���ڲ�������һ������������д�����������������Ӧ����һ�����ܵ������ﱡĤ����ֹ�ڲ�����һ����������
(3)��̽�������ֽ�������ͭ�������Ϊ����ͭ����������������ʵ�����ʱ������Ƶ���ľ�������ҩƷ�ķ�������ȡ�м�Ľ�����Ӧ�Ŀ����Ե�����Һ���������ֶ��õ��ʣ����磬Fe��CuSO4��Ag��Ag��CuSO4����Ӧ��Fe��CuSO4��Ӧ����ѧ����ʽΪ��Fe+CuSO4=Cu+FeSO4����ȡ�м�Ľ����ĵ��ʣ���������ȡ��Ӧ����Һ�����磬Fe(NO3)2��Cu��AgNO3��Fe(NO3)2����Cu��Ӧ��Cu��AgNO3��Ӧ����ѧ����ʽΪ��Cu+2AgNO3=2Ag+Cu(NO3)2������д��Fe+CuSO4=Cu+FeSO4���𰸲�Ψһ���������ɣ���
(4)���ֽ����Ļ����ǿ������˳��Ϊ����>п>��>ͭ>������AgNO3��Cu(NO3)2��Al(NO3)3�Ļ����Һ�м���һ������п�ۺ����۲���ַ�Ӧ��п��������������Ӧ��п��������������Ӧ����������ͭ��Ӧ��Ȼ��������������Ӧ�������������ͭ��Ӧ��
A���������м���ϡ���ᣬ�����ݲ�����˵������������ϡ���ᷴӦ�Ľ������������������֮ǰ�Ľ�����п�����Ľ�����Զ����������ϡ���ᷴӦ��п��ȫ��Ӧ��������������Һ��Ӧ����ˣ������п��ܺ���������п�������ʲ��������⣻
B����Ϊп�����ԭ����������С�����ԣ�п����������Ӧ������Һ������С��п�����ԭ��������ͭ��п������ͭ��Ӧ������Һ���������������ԭ��������ͭ����С���������Ƿ�Ӧ�õ�����Һ�������٣��ɴ˵ó�����Ӧ����Һ���������Դ���ԭ�����Һ��������Ҳ����С��ԭ��Һ�������ʲ��������⣻
C������ҺΪ��ɫʱ��˵����Һ�к���Cu(NO3)2����Ϊ����ͭ��п�ۺ����۶���Ӧ�����ԣ�п�ۺ����۶���Ӧ�꣬��������������п�ۺ����۷�Ӧ�û���������ˣ�������һ��������һ������п�������ʷ������⣻
D���������м���ϡ���ᣬ�����ݲ�����˵�������в���п�������ۣ�������Һ��������̫�࣬��������п�ۺ����۷�Ӧ�꣬����ʣ�࣬��ʱ����Һ��һ���������������磬���Һ�е���������п�ۺ�������ȫ��Ӧ����ʱ����Һ��һ���������������ʲ��������⣬����д��C��

����Ŀ���������ƣ�Na2O2����һ�ֹ������DZˮͧ���ù�����������������ͬʱά��ͧ�ڿ����ɷֵ��ȶ�����ѧ��Ȥ���ϣ�ͬѧ�ǶԹ������ƣ�Na2O2�� ������������������Ũ����Ȥ����������ʦ��ָ����չ��������̽�����
���ṩ���ϣ�2Na2O2+2H2O��4NaOH+O2����������̼��������Ʒ�Ӧ������������һ�����ʡ�
��֤��������̼��������Ʒ�Ӧ�����������ռ�һƿ������
ͬѧ������ʦ��ָ�����������ͼ��ʾװ�ã�
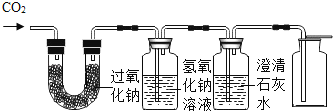
����������Һ��������_____�����۲쵽_____��˵��������̼�Ѿ�������
��̽��������̼��������Ʒ�Ӧ���ɵ���һ�����ʡ�
����������裩������ͬѧ�������3�ֲ��롣
����1������������
����2����̼������
����3����̼����
ͨ���Է�Ӧ�����ɷ�����С����Ϊ����1�Ͳ���2 �Dz���ȷ�ģ�������_____�����������������̼��Ӧ�Ļ�ѧ����ʽΪ_____��
������ʵ�飩ͬѧ��ͨ������ʵ����֤����һ�����ʣ����������ʵ�鱨�档
ʵ����� | ʵ������ | ʵ����� |
ȡ����CO2��Na2O2��Ӧ��Ĺ������Թ��У�_____�� | _____�� | ����3����ȷ�� |