��Ŀ����
����Ŀ��þ�ڿ�����ȼ����������þ�͵���þ��Mg3N2��������þ��ˮ��Ӧ����������þ�Ͱ�����
��1��д��þ�ڵ�����ȼ�����ɵ���þ�Ļ�ѧ����ʽ������þ��ˮ��Ӧ�Ļ�ѧ����ʽ��
��2��12��þ�ڿ�������ȫȼ�����ɹ�������ֵΪg����СֵΪg��
��3��ijѧ���Ըû�����е���þ�������������вⶨ���������ʵ��װ��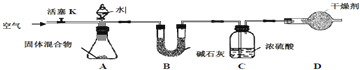
���������ϡ�
������ʯ���ǹ��������ƺ��������ƵĻ������������������NH3 ��Ӧ��
��.2NH3+H2SO4=��NH4��2SO4
����NH3 ��һ�ּ�������ˮ�����壮
��ʵ�鲽�衿���װ�õ������ԡ���ȷ����þ�ڿ�����ȼ�պ�Ĺ���5.00g ������ƿ�С�����װ��C�����Ӻ�װ�á��رջ���K����A �з�Һ©��������μ���ˮ������Ʒǡ����ȫ��Ӧ������K������������ٴγ���װ��C��װ��C ����0.34g��
��ش�
��װ��B����������
��װ��D����������
��ʵ�鲽����й��������Ŀ������
�ܹ���������Mg3N2 ����������Ϊ��
��ʵ��֤���˷����ⶨ�Ľ��ƫ�ͣ�����ԭ������дһ�����ɣ�
���𰸡�
��1��3Mg+N2![]() Mg3N2��Mg3N2+6H2O�T3Mg��OH��2+2NH3��
Mg3N2��Mg3N2+6H2O�T3Mg��OH��2+2NH3��
��2��20��16.67
��3������ˮ��������ֹ�����е�ˮ��������Cװ���У�ʹ���ɵİ�����ȫ��Ũ�������գ�20%�����ְ�������ˮ��
�����������������⣺��1��þ�ڵ�����ȼ�����ɵ���þ�Ļ�ѧ����ʽΪ��3Mg+N2![]() Mg3N2������þ��ˮ��Ӧ�Ļ�ѧ����ʽΪ��Mg3N2+6H2O�T3Mg��OH��2+2NH3����
Mg3N2������þ��ˮ��Ӧ�Ļ�ѧ����ʽΪ��Mg3N2+6H2O�T3Mg��OH��2+2NH3����
2����12gþ��������Ӧ���ɵ�����þ������Ϊx��12gþ�͵�����Ӧ���ɵ���þ������Ϊy��
2Mg+O2![]() 2MgO��
2MgO��
48 80
12g x![]()
x=20g
3Mg+N2![]() Mg3N2 ��
Mg3N2 ��
72 100
12g y![]()
y��16.67
��3����װ��B������������ˮ��������װ��D�������Ƿ�ֹ�����е�ˮ��������Cװ���У���ʵ�鲽����й��������Ŀ����ʹ���ɵİ�����ȫ��Ũ�������գ����赪��þ������Ϊz��װ��C����0.34g��˵��������0.34g������
Mg3N2+6H2O�T3Mg��OH��2+2NH3����
100 34
z 0.34g![]()
z=1g��
����������Mg3N2������������![]() ��100%=20%��
��100%=20%��
��ʵ��֤���˷����ⶨ�Ľ��ƫ�ͣ�����ԭ���Dz��ְ�������ˮ�У�
�𰸣���1��3Mg+N2![]() Mg3N2��Mg3N2+6H2O�T3Mg��OH��2��+2NH3������2��20�� 16.67����3��������ˮ������ �ڷ�ֹ�����е�ˮ��������Cװ���У� ��ʹ���ɵİ�����ȫ��Ũ�������գ���20%�� �ݲ��ְ�������ˮ�У�
Mg3N2��Mg3N2+6H2O�T3Mg��OH��2��+2NH3������2��20�� 16.67����3��������ˮ������ �ڷ�ֹ�����е�ˮ��������Cװ���У� ��ʹ���ɵİ�����ȫ��Ũ�������գ���20%�� �ݲ��ְ�������ˮ�У�
�����㾫�������������غ㶨�ɼ���Ӧ�ú���д��ѧ����ʽ�����ֱ���ʽ�����뷽��ʽ����Ŀ�����жϼ��ɵõ��𰸣���Ҫ��֪�������غ㶨��ֻ�����ڻ�ѧ�仯���������������仯���ڲ��μӷ�Ӧ����������������������������������ܼ��롰�ܺ͡��У���Ҫ���ǿ����е������Ƿ�μӷ�Ӧ�����ʣ������壩������©��ע�⣺a����ƽ b������ c�����ţ�
