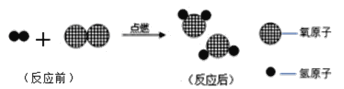
题目内容
【题目】金属在生产、生活中有广泛应用。
(1)我国深水钻井平台“981”用钢量达3万吨,露出平台的钢很容易生锈,铁锈的主要成分是____________(填化学式),写出用盐酸除去铁制品表面铁锈的化学方程式____________。
(2)现有含杂质的赤铁矿(主要成分为 Fe2O3)样品,为了测定该样品中氧化铁的质量分数,某同学取该样品 5.0g。该同学在实验室用一氧化碳还原赤铁矿(杂质不参加反应)。装置示意图如下:
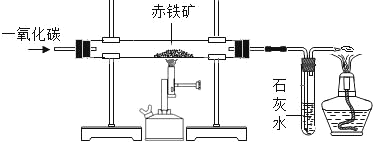
①在直形管内发生反应的化学方程式是:____________。
②下列关于该实验的操作描述正确的是_________________。
A开始时应先预热玻璃管,后通入一氧化碳
B反应过程可观察到固体由黑色逐渐变红
C盛装药品前应先检查装置气密性
D将尾气点燃或收集,可防止一氧化碳污染空气
③样品充分反应后,测定实验数据,澄清石灰水增重 3.3g.计算:
I.反应生成 CO2 的质量是____________;
II.该样品中氧化铁的质量分数是____________。
(3)某化学兴趣小组同学在实验室将一定质量的锌粉放入盛有硝酸银、硝酸铜和硝酸镁的混合溶液中,充分反应后过滤,得到滤渣和滤液,滤液呈无色。
①滤渣中一定含有的金属是____________。
②滤液中一定含有的阳离子是_______________。
【答案】![]()
![]()
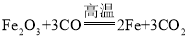 CD 3.3g 80% 银、铜 镁离子和锌离子
CD 3.3g 80% 银、铜 镁离子和锌离子
【解析】
铁和氧气、水生成铁锈,氧化铁和盐酸生成氯化铁和水,一氧化碳和氧化铁高温生成铁和二氧化碳,二氧化碳和氢氧化钙反应生成碳酸钙和水。
(1)铁和氧气和水生成铁锈,铁锈的主要成分是氧化铁,化学式为![]() ,用盐酸除去铁制品表面铁锈的反应是氧化铁和盐酸生成氯化铁和水,反应的化学方程式为
,用盐酸除去铁制品表面铁锈的反应是氧化铁和盐酸生成氯化铁和水,反应的化学方程式为![]() 。
。
(2)①在直形管内发生反应是一氧化碳和氧化铁高温生成铁和二氧化碳,反应的化学方程式为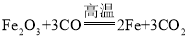 。
。
②A、开始时应先通入一氧化碳,后预热玻璃管,故A不正确;
B、一氧化碳和氧化铁高温生成铁和二氧化碳,反应过程可观察到固体由红色逐渐变黑,故B不正确;
C、盛装药品前应先检查装置气密性,故C正确;
D、将尾气点燃或收集,可防止一氧化碳污染空气,故D正确。故选CD。
③I.二氧化碳和氢氧化钙反应生成碳酸钙和水,样品充分反应后,测定实验数据,澄清石灰水增重 3.3g,故反应生成 CO2 的质量是3.3g。
II.设该样品中氧化铁的质量为x

![]()
![]()
故样品中氧化铁的质量分数为![]() 。
。
(3)锌的金属活动性比银、铜强,比镁弱,不能与Mg(NO3)2溶液反应;将一定质量的锌粉放入盛有硝酸银、硝酸铜和硝酸镁的混合溶液中,锌先与AgNO3溶液反应生成硝酸锌溶液和银,AgNO3反应完,若还有锌粉,锌才能与Cu(NO3)2溶液反应生成硝酸锌溶液和铜,充分反应后过滤,得到滤渣和滤液,滤液呈无色,说明溶液中不含硝酸铜,则可能是锌与硝酸铜溶液恰好完全反应,也可能是锌有剩余。
①滤渣中一定含有的金属是银、铜。
②滤液中一定含有的阳离子是镁离子和锌离子。