题目内容
【题目】通过晾晒海水或煮井盐水、盐湖水等,可以蒸发除去水分,得到粗盐。粗盐中含有多种可溶性杂质(氯化镁、氯化钙等)和不溶性杂质(泥沙等)。通过如图所示过程,使粗盐得到初步提纯:
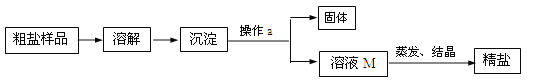
(1)操作a的名称是 ,该操作中需要用到的玻璃仪器有烧杯、玻璃棒、 。
(2)通过蒸发M溶液中的水分使之浓缩结晶,想一想:能否采用降低溶液温度的方法来达到同一目的? (填“能”或“否”),理由是 。
(3)在蒸发操作时,当蒸发皿中出现较多量固体时,应 ,利用蒸发皿的余热使滤液蒸干。
(4)某同学欲通过实验探究所得精盐是否是纯净物,进行了如下实验。
实验步骤 | 实验现象 | 实验结论 |
取一定量精盐样品于试管中,加水使之完全溶解,并向其中加入 ① | ② | 写出一个相应的化学方程式: ③ 结论:该精盐样品为混合物 |
【答案】(1) 过滤 漏斗 (2) 否 氯化钠的溶解度受温度影响小 (3) 停止加热
(4) ① Na2CO3溶液 ②产生白色沉淀 ③Na2CO3 + CaCl2 = CaCO3↓ + 2NaCl
(或:Na2CO3 + MgCl2 = MgCO3↓ + 2NaCl )
(或:①NaOH溶液 ②产生白色沉淀 ③MgCl2 + 2NaOH = Mg(OH)2↓ + 2NaCl) (合理即可)
【解析】
试题分析:因为经过操作a,固液分离了,故(1)操作a的名称是过滤,其操作中需要用到的玻璃仪器有烧杯、玻璃棒、漏斗;(2)通过蒸发M溶液中的水分使之浓缩结晶,不能采用降低溶液温度的方法来达到同一目,理由是氯化钠的溶解度受温度影响小;(3)在蒸发操作时,当蒸发皿中出现较多量固体时,应停止加热,利用蒸发皿的余热使滤液蒸干,防止溶质的损失;(4)根据结论可知,取一定量精盐样品于试管中,加水使之完全溶解,并向其中加入Na2CO3溶液 ,观察到产生白色沉淀,说明是混合物;涉及到的方程式为:Na2CO3 + CaCl2 = CaCO3↓ + 2NaCl。