题目内容
【题目】实验小组用 pH 传感器探究稀盐酸和氢氧化钠溶液的反应。实验操作和测定结果如图所示:
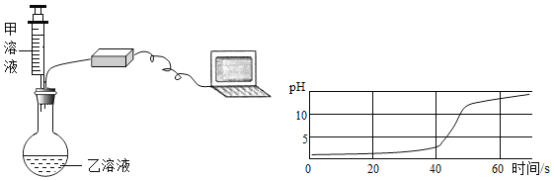
(1)盐酸和氢氧化钠反应的化学方程式为__________。
(2)该实验中,甲溶液是_________。
(3)能说明盐酸与氢氧化钠发生化学反应的依据是__________。
(4)60 s 时,烧瓶内溶液中的溶质是_________。
【答案】NaOH+HCl═NaCl+H2O 氢氧化钠溶液 溶液的pH不断增大且大于7 氢氧化钠和氯化钠
【解析】
(1)盐酸和氢氧化钠反应生成氯化钠和水,反应的化学方程式为NaOH+HCl═NaCl+H2O。
(2)该实验中,滴加甲溶液前pH小于7,溶液显酸性,说明乙溶液是稀盐酸,则甲溶液是氢氧化钠溶液,随着氢氧化钠溶液加入,pH不断增大。
(3)能说明盐酸与氢氧化钠发生化学反应的依据是溶液的pH不断增大且大于7。
(4)60 s 时,烧瓶内溶液pH大于7,说明氢氧化钠溶液过量,稀盐酸完全反应,溶液中的溶质是氢氧化钠和氯化钠。

【题目】小鑫同学在实验室做制取氧气的实验,他取氯酸钾和二氧化锰的混合物 6.0 g 放入大试管中进行加热,并在不同时刻测定试管内剩余固体的质量如下表:
反应时间/min | 1.0 | 2.0 | 3.0 | 4.0 |
剩余固体质量/g | 5.1 | 4.2 | 4.08 | 4.08 |
分析表中数据,完成下列问题:
(1)生成氧气的质量为_____g。
(2)原混合物中氯酸钾的质量是多少?_____(写出计算过程,计算结果精确到 0.1)
【题目】在一个密闭容器中放入X、Y、Z、W 四种物质,在一定条件下发生化学反应,一段时间后,测得有关说法如下表,则关于此反应的认识不正确的是 ( )
物质 | X | Y | Z | W |
反应前的质量 | 2 | 1 | 16 | 16 |
反应后的质量 | 17 | m | 6 | 11 |
A.物质Y 可能是该反应的催化剂B.该反应为复分解反应
C.反应后 Z 和Y 的质量比为 6:1D.参加反应的 Z 和W 的质量比为 2:1