题目内容
现将16.0g镁和铜的混合物粉末放入烧杯中,再将200.0g的稀硫酸分四次加入到该烧杯中,充分反应后,测得剩余固体质量的数据记录如下:
根据题意回答下列问题:
(1)该混合物粉末中铜的质量为多少克?
(2)所用硫酸溶液中溶质的质量分数是多少?(只写结果即可)
(3)配制上述溶质质量分数的硫酸溶液200.0g,需要溶质质量分数为98%的浓硫酸的体积是多少?已知98%的浓硫酸的密度为1.84g/cm3.(写出计算过程,结果精确到0.1)
| 次数 | 1 | 2 | 3 | 4 |
| 加入稀硫酸的质量/g | 50.0 | 50.0 | 50.0 | 50.0 |
| 剩余固体的质量/g | 13.6 | 11.2 | 8.8 | 8.4 |
(1)该混合物粉末中铜的质量为多少克?
(2)所用硫酸溶液中溶质的质量分数是多少?(只写结果即可)
(3)配制上述溶质质量分数的硫酸溶液200.0g,需要溶质质量分数为98%的浓硫酸的体积是多少?已知98%的浓硫酸的密度为1.84g/cm3.(写出计算过程,结果精确到0.1)
考点:根据化学反应方程式的计算,有关溶质质量分数的简单计算
专题:综合计算(图像型、表格型、情景型计算题)
分析:根据表中数据可以判断铜的质量;
根据硫酸的质量和稀硫酸的质量可以计算稀硫酸的质量分数;
溶液稀释前后,溶质质量不变.
根据硫酸的质量和稀硫酸的质量可以计算稀硫酸的质量分数;
溶液稀释前后,溶质质量不变.
解答:解:(1)铜不能和稀硫酸反应,镁能和稀硫酸反应生成硫酸镁和氢气,反应后剩余固体是铜,由表中数据可知,铜的质量是8.4g,
答:该混合物粉末中铜的质量为8.4g.
(2)设50.0g稀硫酸中硫酸的质量为x,
由第一次数据可知,50.0g稀硫酸和2.4g镁恰好完全反应,
Mg+H2SO4═MgSO4+H2↑,
24 98
2.4g x
=
,
x=9.8g,
所用硫酸溶液中溶质的质量分数为:
×100%=19.6%,
答:所用硫酸溶液中溶质的质量分数为19.6%.
(3)设需要溶质质量分数为98%的浓硫酸的体积为y,
根据溶液稀释前后溶质质量不变有:y×1.84g/cm3×98%=200.0g×19.6%,
y=21.7cm3,
答:需要溶质质量分数为98%的浓硫酸的体积为21.7cm3.
答:该混合物粉末中铜的质量为8.4g.
(2)设50.0g稀硫酸中硫酸的质量为x,
由第一次数据可知,50.0g稀硫酸和2.4g镁恰好完全反应,
Mg+H2SO4═MgSO4+H2↑,
24 98
2.4g x
| 24 |
| 2.4g |
| 98 |
| x |
x=9.8g,
所用硫酸溶液中溶质的质量分数为:
| 9.8g |
| 50.0g |
答:所用硫酸溶液中溶质的质量分数为19.6%.
(3)设需要溶质质量分数为98%的浓硫酸的体积为y,
根据溶液稀释前后溶质质量不变有:y×1.84g/cm3×98%=200.0g×19.6%,
y=21.7cm3,
答:需要溶质质量分数为98%的浓硫酸的体积为21.7cm3.
点评:本题主要考查学生运用假设法和化学方程式进行计算和推断的能力,计算时要注意规范性和准确性.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
加热50mL液体应该选用下列仪器中的( )
①试管;②烧杯;③酒精灯;④试管夹;⑤石棉网;⑥铁架台;⑦漏斗;⑧集气瓶.
①试管;②烧杯;③酒精灯;④试管夹;⑤石棉网;⑥铁架台;⑦漏斗;⑧集气瓶.
| A、①③④ | B、②③⑤⑥ |
| C、③④⑧ | D、①③⑤⑥ |
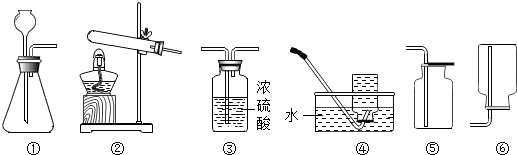
 如图所示装置有多种用途,请回答下列问题:
如图所示装置有多种用途,请回答下列问题:
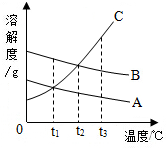 如图是A、B、C三种固体物质的溶解度曲线,试看图后回答
如图是A、B、C三种固体物质的溶解度曲线,试看图后回答