题目内容
铝、铁、铜是我们生活中常见的金属.(1)根据图,总结金属具有的物理性质有 .

(2)铝制品具有很好的抗腐蚀性能,原因是 .
(3)炼铁厂通常以焦炭(主要成分是C)、赤铁矿(主要成分是氧化铁)、空气等为主要原料炼铁,反应过程如图:

写出CO与赤铁矿反应的化学方程式 .取少量炼出的生铁粉末放入烧杯中,加入过量稀盐酸,可观察到的现象是
.
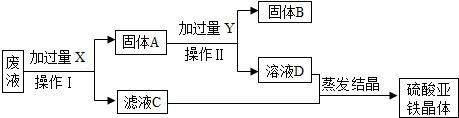
(4)某实验室的废液中含有大量的FeSO4、CuSO4,小刚同学欲从上述废液中回收Cu,并得到副产品FeSO4,设计实验流程如图所示,回答问题:
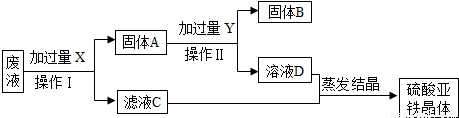
①操作I和操作II的名称是 .
②写出上述流程中所涉及的反应的化学方程式 .
【答案】分析:(1)根据图示,掌握常见金属的性质,明白金属和人类生活关系密切.
(2)熟悉铝制品的化学性质氧化性,知其在常温下易氧化;
(3)炼铁厂通常以焦炭(主要成分是C)、赤铁矿(主要成分是氧化铁)、空气等为主要原料炼铁,反应过程有流程图示知:C+O2 CO2、CO2+C
CO2、CO2+C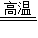 2CO、3CO+Fe2O3
2CO、3CO+Fe2O3 2Fe+3CO2;冶炼得到的生铁是铁的合金,属混合物,里面混有少量的杂质.
2Fe+3CO2;冶炼得到的生铁是铁的合金,属混合物,里面混有少量的杂质.
(4)对于废液的处理,根据所含的成分是硫酸铜和硫酸亚铁,目的是分离出铜和硫酸亚铁晶体,就要加入过量的铁,把硫酸铜转化为铜和硫酸亚铁,再除去过量的铁,最后达到实验目的.
解答:解:(1)根据图象,结合常见金属的性质得知金属具有的物理性质有:导热性、导电性、延展性;
(2)铝制品具有很好的抗腐蚀性能,在现实生活中应用广泛,主要原因是:铝在空气中与氧气反应,其表面生成一层致密的氧化铝薄膜,阻止铝进一步氧化.
(3)炼铁厂通常以焦炭(主要成分是C)、赤铁矿(主要成分是氧化铁)、空气等为主要原料炼铁,反应过程有流程图示知:C+O2 CO2、CO2+C
CO2、CO2+C 2CO、3CO+Fe2O3
2CO、3CO+Fe2O3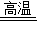 2Fe+3CO2;冶炼得到的生铁;当向生铁中加入过量稀盐酸时,铁完全反应产生气泡溶液变成浅绿,反应完全后有黑色不溶物,即里面混有少量的杂质(炭等).故答案为:3CO+Fe2O3
2Fe+3CO2;冶炼得到的生铁;当向生铁中加入过量稀盐酸时,铁完全反应产生气泡溶液变成浅绿,反应完全后有黑色不溶物,即里面混有少量的杂质(炭等).故答案为:3CO+Fe2O3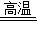 2Fe+3CO2;生铁逐渐溶解,有气泡产生,溶液变成浅绿,反应完全后烧杯底部有黑色不溶物.
2Fe+3CO2;生铁逐渐溶解,有气泡产生,溶液变成浅绿,反应完全后烧杯底部有黑色不溶物.
(4)从实验方案看出,要从含硫酸亚铁和硫酸铜的废水中得到铜和硫酸亚铁,第一步要先加过量的铁,把铜置换出来,同时生成硫酸亚铁,过滤后所得的固体里含有铁和铜,要想把铁除去,可用稀硫酸与铁反应,铜与硫酸不反应,过滤就得到铜了,再把两次所得滤液进行蒸发,即可得到硫酸亚铁晶体.故答案为:过滤、Fe+CuSO4═FeSO4+Cu; Fe+H2SO4=FeSO4+H2↑
故答案为::(1)导热性、导电性、延展性;
(2)铝在空气中与氧气反应,其表面生成一层致密的氧化铝薄膜,阻止铝进一步氧化.
(3)3CO+Fe2O3 2Fe+3CO2;生铁逐渐溶解,有气泡产生,溶液变成浅绿,反应完全后烧杯底部有黑色不溶物.
2Fe+3CO2;生铁逐渐溶解,有气泡产生,溶液变成浅绿,反应完全后烧杯底部有黑色不溶物.
(4)过滤、Fe+CuSO4═FeSO4+Cu; Fe+H2SO4=FeSO4+H2↑
点评:本题考查了常见金属的物理性质,铝的氧化性,生铁的冶炼过程及组成,废水的处理,化学方程式的书写等方面的内容,涉及知识面广,考查内容丰富,堪为好题.
(2)熟悉铝制品的化学性质氧化性,知其在常温下易氧化;
(3)炼铁厂通常以焦炭(主要成分是C)、赤铁矿(主要成分是氧化铁)、空气等为主要原料炼铁,反应过程有流程图示知:C+O2
 CO2、CO2+C
CO2、CO2+C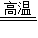 2CO、3CO+Fe2O3
2CO、3CO+Fe2O3 2Fe+3CO2;冶炼得到的生铁是铁的合金,属混合物,里面混有少量的杂质.
2Fe+3CO2;冶炼得到的生铁是铁的合金,属混合物,里面混有少量的杂质.(4)对于废液的处理,根据所含的成分是硫酸铜和硫酸亚铁,目的是分离出铜和硫酸亚铁晶体,就要加入过量的铁,把硫酸铜转化为铜和硫酸亚铁,再除去过量的铁,最后达到实验目的.
解答:解:(1)根据图象,结合常见金属的性质得知金属具有的物理性质有:导热性、导电性、延展性;
(2)铝制品具有很好的抗腐蚀性能,在现实生活中应用广泛,主要原因是:铝在空气中与氧气反应,其表面生成一层致密的氧化铝薄膜,阻止铝进一步氧化.
(3)炼铁厂通常以焦炭(主要成分是C)、赤铁矿(主要成分是氧化铁)、空气等为主要原料炼铁,反应过程有流程图示知:C+O2
 CO2、CO2+C
CO2、CO2+C 2CO、3CO+Fe2O3
2CO、3CO+Fe2O3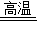 2Fe+3CO2;冶炼得到的生铁;当向生铁中加入过量稀盐酸时,铁完全反应产生气泡溶液变成浅绿,反应完全后有黑色不溶物,即里面混有少量的杂质(炭等).故答案为:3CO+Fe2O3
2Fe+3CO2;冶炼得到的生铁;当向生铁中加入过量稀盐酸时,铁完全反应产生气泡溶液变成浅绿,反应完全后有黑色不溶物,即里面混有少量的杂质(炭等).故答案为:3CO+Fe2O3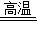 2Fe+3CO2;生铁逐渐溶解,有气泡产生,溶液变成浅绿,反应完全后烧杯底部有黑色不溶物.
2Fe+3CO2;生铁逐渐溶解,有气泡产生,溶液变成浅绿,反应完全后烧杯底部有黑色不溶物.(4)从实验方案看出,要从含硫酸亚铁和硫酸铜的废水中得到铜和硫酸亚铁,第一步要先加过量的铁,把铜置换出来,同时生成硫酸亚铁,过滤后所得的固体里含有铁和铜,要想把铁除去,可用稀硫酸与铁反应,铜与硫酸不反应,过滤就得到铜了,再把两次所得滤液进行蒸发,即可得到硫酸亚铁晶体.故答案为:过滤、Fe+CuSO4═FeSO4+Cu; Fe+H2SO4=FeSO4+H2↑
故答案为::(1)导热性、导电性、延展性;
(2)铝在空气中与氧气反应,其表面生成一层致密的氧化铝薄膜,阻止铝进一步氧化.
(3)3CO+Fe2O3
 2Fe+3CO2;生铁逐渐溶解,有气泡产生,溶液变成浅绿,反应完全后烧杯底部有黑色不溶物.
2Fe+3CO2;生铁逐渐溶解,有气泡产生,溶液变成浅绿,反应完全后烧杯底部有黑色不溶物.(4)过滤、Fe+CuSO4═FeSO4+Cu; Fe+H2SO4=FeSO4+H2↑
点评:本题考查了常见金属的物理性质,铝的氧化性,生铁的冶炼过程及组成,废水的处理,化学方程式的书写等方面的内容,涉及知识面广,考查内容丰富,堪为好题.

练习册系列答案
相关题目






 铝、铁、铜是我们生活中常见的金属.
铝、铁、铜是我们生活中常见的金属.